Pytania egzaminacyjne chemia
Ad.1 Model atomu Bohra
W atomie elektrony krążą wokół jądra po orbitach, które są skwantowane ( mają określoną energie, która według postulatu Plancka jest porcjowana a nie ciągła). Podczas zmiany orbity, czyli zmiany poziomu energetycznego elektron emituje foton, którego energia jest równa różnicy energii pomiędzy poziomami energetycznymi. Dodatkowo z postulatów Bohra można obliczyć promień orbity, po której krąży elektron oraz jego energie z przyrównania siły dośrodkowej do siły elektrostatycznej.
Ad.2 Falowy model atomu
Cząstki elementarne składające się na atom mają charakter falowy, czyli można im przypisać np. długość fali. Pęd cząsteczek można obliczać tak jak pęd fotonu według wzoru
Równaniem ruchu falowego dla elektronu jest równanie Schrodingera.
Ad.3 Liczby kwantowe
- główna liczba kwantowa (n) - określa energie elektronu i tym samym powłokę, na jakiej się znajduje
-orbitalna (poboczna) liczba kwantowa (l) - określa moment pędu elektronu i przypisuje mu podpowłokę (np. s=0,p=1,d=2).
-magnetyczna liczba kwantowa (m) - określa usytuowanie pola magnetycznego własnego elektronu względem pola zewnętrznego poprzez rzut momentu pędu elektronu. Różnice w usytuowaniu w polu magnetycznym sprawiają ze elektrony jednej powłoki nieznacznie różnią się energetycznie np. dla orbitalu typu p (-2,-1,0,1,-1,2)
-magnetyczna spinowa liczba kwantowa (ms) - określa kierunek spinu, czyli własnego momentu pędu cząstki (-1/2 lub 1/2)
Ad.4 Orbitale
Google -> grafika -> „orbitale”
Ad.5 Zapełnianie powłok elektronowych
Nieprecyzyjne pytanie. Każdy pierwiastek ma inny schemat zapełniania powłok elektronowych. Maksymalna ilość elektronów w powłokach wynosi 2n2 gdzie n to główna liczba kwantowa:
Powłoka K (podpowłoka s) (n=1) -> 2 elektrony
Powłoka L (podpowłoka s,p) (n=2) -> 8 elektronów itd.
Ad.6 Struktura elektronowa
Np. dla fosforu
1s2,2s2,2p6,3s2,3p3
arsenu
1s2,2s2,2p6,3s2,3p6,3d10, 4s2,4p3
Ad.7 Budowa układu okresowego
Układ okresowy dzieli się na grupy (główne i poboczne), które określają ilość elektronów na powłokach walencyjnych, przez co pierwiastki leżące w tych samych grupach mają podobne właściwości. Okresy określają ilość powłok elektronowych. Pierwiastki są uszeregowane według rosnącej liczby atomowej mówiącej o ilości elektronów i protonów w atomie pierwiastka.
Ad. 8-11 Wiązania chemiczne
W cząsteczkach występują dwa rodzaje oddziaływań:
-wymiana elektronów prowadząca do powstawania wiązań chemicznych
-oddziaływania międzycząsteczkowe zwane siłami van der Waalsa
Wiązania kowalencyjne to takie, w których atomy posiadają wspólną parę lub pary elektronów (pochodzą one z obu atomów a nie tylko z jednego). Jeśli łączą się takie same atomy jak np. w cząsteczce O2 to uwspólnione elektrony są umieszczone symetrycznie, a wiązanie to jest kowalencyjne niespolaryzowane. Jeśli atomy są różne jak np. w HF wtedy elektrony są skierowane w kierunku atomu pierwiastka bardziej elektroujemnego. Jeśli różnica elektroujemności nie przekracza 1,7 w skali Paulinga mamy do czynienia z wiązaniami kowalencyjnymi spolaryzowanymi.
Gdy łączą się atomy pierwiastków różniących się znacznie elektroujemnością (1,7<) polaryzacja jest na tyle duża, że elektron (lub elektrony) przenoszą się na atom bardziej elektroujemny. W ten sposób powstaje wiązanie jonowe. Atom, który otrzymał elektrony staje się anionem, a atom, który oddał elektrony staje się kationem (np. NaCl)
Ad.12 Hybrydyzacja
Hybrydyzacja to teoretyczne ustalenie kształtu i energii łączących się ze sobą orbitali na podstawie budowy cząsteczek. Najważniejsze rodzaje hybrydyzacji to:
-sp - prowadząca do powstania wiązania leżącego w jednej lini pod kątem 180 stopni (np.CO2 lub C2H2)
-sp2- prowadząca do powstania wiązania leżącego w płaszczyźnie trójkąta równobocznego gdzie wiązania są usytuowane pod kątem 120 stopni (np. BF3 lub C6H6)
-sp3 - wiązania tworzą figurę zbliżoną do tetraedru gdzie kąty pomiędzy wiązaniami wynoszą 109 stopni (np. H20, NH3, CH4)
Ad.13 Rysunek orbitali po hybrydyzacji
wikipedia
Ad.14 Wiązania sigma i wiązania pi
Wiązania sigma powstają podczas łączenia się orbitali molekularnych (orbitali służących, jako funkcja położenia elektronu w cząsteczce). Wiązania te powstają poprzez połączenie dwóch orbitali typu s, orbitalu s i p, oraz nałożenie się dwóch orbitali typu p wzdłuż osi cząsteczki ( nałożenie czołowe).
Wiązania pi może powstać poprzez boczne nałożenie się orbitali wszystkich typów oprócz typu s.
Ad.15 Wiązania metaliczne
Wiązania metaliczne charakteryzują się tym, że kationy metali tworzą regularnie upakowaną sieć krystaliczną, pomiędzy którymi swobodnie poruszają się elektrony. Cecha ta powoduje dobre przewodnictwo elektryczne metali. Pomiędzy dodatnimi jonami a zdelokalizowanymi elektronami występują silne oddziaływania co powoduje dużą odporność mechaniczą metali.
Ad.16 Wiązania wodorowe
Wiązania wodorowe powstają między cząsteczkami gdzie wodór łączy się z wysoko elektroujemnym atomem np. tlenem. W cząsteczce atom wodoru jest połączony z atomem elektroujemnym wiązaniem kowalencyjnym tak silnie spolaryzowanym, że nadmiar ładunków dodatnich wodoru prowadzi do oddziaływania pomiędzy nim a atomem sąsiedniej cząsteczki, na którym jest silny ładunek ujemny. W ten sposób pomiędzy wodorem a atomem elektroujemnym sąsiedniej cząsteczki występują dipolowe przyciągania elektrostatyczne lub wiązanie kowalencyjne z wodorem jako akceptorem elektronów a atomem elektroujemnym jako donorem pary elektronowej.
Ad.17 Gazy rzeczywiste i doskonałe
Tutaj jest błąd bo przemiana izotermiczna (prawo Boyle'a - Mariotte'a ) dotyczy gazu doskonałego a nie rzeczywistego. Gdy T= const w gazie doskonałym występuje zależność p1v1=p2v2
Objętość jest odwrotnie proporcjonalna do ciśnienia. pV = const
Równianie Clapeyrona dla gazu doskonałego: pV = nRT , gdzie p to ciśnienie, V objętość , n liczba moli , R stała gazowa 8,31 J/mol*k, T temperatura
Równanie gazu rzeczywistego:
(p+
) (v-nb) = nRT , gdzie `a' to stała charakteryzująca oddziaływania van der Waalsa, a `b' to stała dotycząca objętości własnej cząsteczek gazu.
Ad.18 Oddziaływania cząsteczek w gazie rzeczywistym
W gazach rzeczywistych oddziaływania międzycząsteczkowe (siły van der Waalsa i zderzenia) oraz objętości własne cząsteczek nie są pomijane tak jak w przypadku gazów doskonałych.
Ad.19 Ugrupowania występujące w wodzie
-Zespoły cząstek powiązane wiązaniami wodorowymi (asocjaty)
- jony OH- oraz H3O+ powstałe z autodysocjacji wody
Ad.20 Moment dipolowy
Moment dipolowy jest miarą polarności wiązania między atomami lub cząsteczkami związków. Trwałe momenty dipolowe powstają wtedy, gdy w cząsteczkach na stale występują ładunki rozmieszczone biegunowo.
W cząsteczce nie posiadającej trwałego momentu dipolowego na skutek fluktuacji chmur elektronowych tej cząsteczki może powstać chwilowy moment dipolowy. W cząsteczce posiadającej chwilowy moment dipolowy może on być przenoszony na sąsiednie cząstki niepolarne wytwarzając między nimi oddziaływania. Cząsteczka o chwilowym momencie dipolowym może też oddziaływać z cząstką o trwałym momencie dipolowym, a oddziaływanie to jest podobne jak oddziaływanie dwóch cząstek polarnych.
Moment dipolowy wyindukowany powstaje, gdy w obrębie cząstki mającej trwały moment dipolowy znajdzie się cząsteczka niepolarna.
Ad.21 Izotropia, anizotropia, izomeria, polimorfizm, alotropia
Izotropia to brak zależności właściwości fizycznych od kierunku ich pomiaru w materiale. Występuje w ciałach bezpostaciowych.
Anizotropia to przeciwieństwo izotropii a więc jest to istnienie zależności pomiędzy zmianami właściwości fizycznych a kierunkiem ich pomiaru. Występuje w kryształach.
Izomeria to istnienie różnic w budowie związków o takim samym składzie chemicznym. Dzieli się na izomerie konstytucyjną (strukturalną) oraz stereoizomerię (przestrzenną).
Polimorfizm to istnienie różnic w budowie krystalicznej tych samych substancji ( np. węgiel jako diament i grafit).
Alotropia to rodzaj polimorfizmu polegającym na tym, że te same substancje występują w różnych odmianach różniących się właściwościami chemicznymi, fizycznymi lub budową krystaliczną czy liczbą atomów w cząsteczce (np. tlen w postaci O2 , O3, O4 )
Ad.22 Napięcie powierzchniowe
Pytanie zostało oklepane na laborkach.
Ad.23 Komórki krystaliczne
Wikipedia > hasło: sieć krystaliczna
Ad.24 Rodzaje kryształów
Kryształy molekularne to kryształy gdzie między cząsteczkami występują tylko oddziaływania van der Waalsa (np.amoniak, dwutlenek węgla, krystaliczne związki organiczne takie jak cukier). Właściwości:
-niska temperatura topnienia
-niska wytrzymałość mechaniczna
-wysoka rozszerzalność cieplna
-niskie przewodnictwo elektryczne
Kryształy kowalencyjne to takie gdzie atomy tworzą sieci krystaliczne połączone odpowiednio ukierunkowanymi wiązaniami kowalencyjnymi (np. diament, kwarc). Właściwości:
-wysoka temperatura topnienia
-niska rozszerzalność cieplna
-duża odporność mechaniczna
-bardzo małe przewodnictwo elektryczne
Kryształy metaliczne (patrz wiązanie metaliczne). Właściwości:
-różna temperatura topnienia
-wytrzymałość mechaniczna zazwyczaj duża
-rozszerzalność cieplna i przewodnictwo elektryczne duże
-zdolność do tworzenia roztworów stałych:
>substytucyjnych ( gdzie kationy innych pierwiastków mogą zastąpić kationy metali sieci krystalicznej)
>międzywęzłowych (gdzie małe atomy takie jak wodór zajmują przestrzeń międzyatomową w sieci krystalicznej nie powodując istotnych zmian w jej strukturze)
Ad.25 Reguła faz Gibbsa
Wikipedia - jeśli ktoś ma cierpliwość do tego bełkotu
W skrócie reguła dotyczy układów fazowych i mówi, że suma liczby stopni swobody (parametrów układu których zmiana nie spowoduje zmiany stanu skupienia ->fazy) oraz liczby niezmienionych faz równa się najmniejszej liczbie niezależnych składników chemicznych wystarczających do jakościowego określenia układu.
Ad.26 Wykres ciśnienie -temperatura dla wody
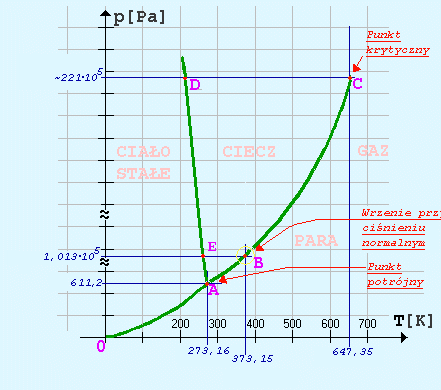
Ad.27 Sposoby wyrażania stężeń w roztworze
- Stężenie molowe - liczba moli w określonej objętości Cm =n/V
-Stężenie procentowe - określa ile procent masy substancji rozpuszczonej znajduje się w roztworze względem całości jego masy (masy substancji rozpuszczonej i rozpuszczalnika) > Cp=
*100%
Ad.28 Proces destylacji
Diagram -> Google grafika-> destylacja. Destylacja polega na wykorzystaniu różnicy w temperaturach wrzenia dwóch substancji w celu oddzielenia jednej od drugiej. Substancja o temperaturze wrzenia mniejszej odparowuje z roztworu i skrapla się w innym naczyniu.
Ad.29 Wykresy fazowe roztworu i czystej wody
Z wykresu fazowego roztworu wodnego powinno wynikać, że ma on większą temperaturę wrzenia i mniejszą temperaturę krzepnięcia od czystej wody.
Ad.30 Destylacja zwykła i frakcjonowana
Destylacja zwykła - destylacja jednopoziomowa (patrz pyt.28)
Destylacja frakcjonowana (rektyfikacja) - destylacja wielopoziomowa polegająca na oddzieleniu frakcji o podobnej lotności z ciekłej mieszaniny.
Ad.31 Azeotropy
Azeotropy są to roztwory cieczy, w których podczas wrzenia skład pary jest identyczny w stosunku do składu cieczy wrzącej. Układem azeotropowym nazywamy układ fazowy, w którym prężność pary ( ciśnienie, przy którym faza gazowa roztworu pozostaje w równowadze z fazą ciekłą) osiąga swoją maksymalną (azeotrop dodatni) lub minimalną (azeotrop ujemny) wartość.
Szczegóły + wykresy: http://www.mlyniec.gda.pl/~chemia/ogolna/substancje/substancja_procesy.htm
Ad.32
Nie wiadomo, o który podział chodzi. Podam podział ze względu na możliwość zajścia reakcji fazy rozproszonej z ośrodkiem rozpraszającym:
-liofilowe (Fe(OH)3 , Al(OH)3)
-liofobowe (AgCl, As2S3) szczegóły w instrukcji do koloidów
Ad.33
Również odsyłam do instrukcji z koloidów
Ad.34 Diagram fazowy temperatura-skład
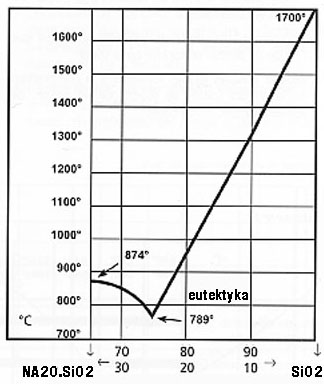
Ad.35 2,2,4,5 - tetrametylo - 4,5 dietylo heptan
CH3 CH2CH3 CH2CH3
| | |
CH3 - C - CH2 - C - C - CH2 - CH3
| | |
CH3 CH3 CH3
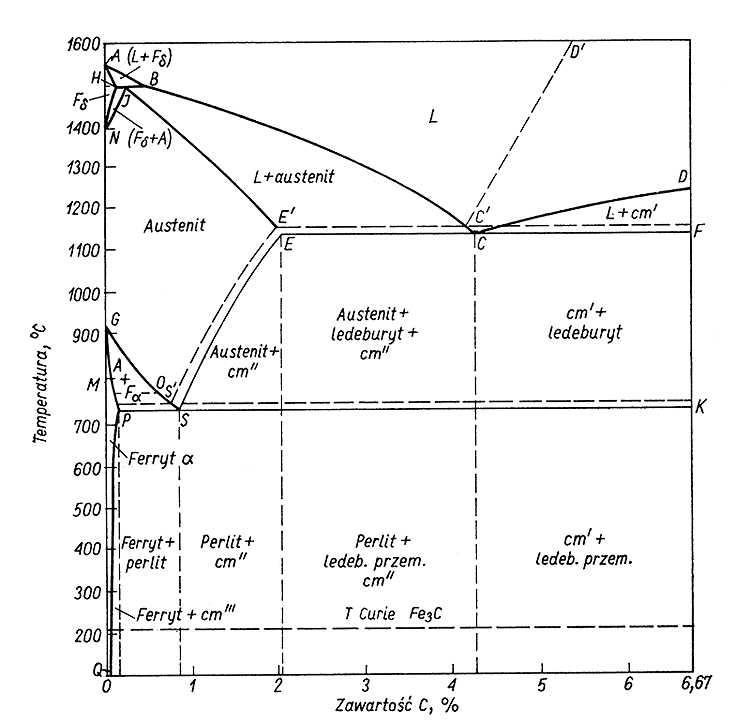
Ad.36 Wykres fazowy węgiel-żelazo. Jasne jak słońce
6,67% węgla > powstaje cementyt Fe3C
4,43% węgla > powstaje ledeburyt
0,8% węgla > powstaje perlit
Ad.37 Alkany
metan, etan, propan, butan, pentan, heksan, heptan, oktan, nonan, dekan
wzór ogólny: CnH2n+2
Ad.38 Metan i eten
Nietrudno znaleźć
Ad.39 Izomeria
Izomeria to występowanie tych samych związków o takiej samej ilości atomów czy cząsteczek lecz o różnej budowie. Istnieje izomeria:
- konstytucyjna (strukturalna )
> położenie wiązania podwójnego np. Pent-2-en i pent-3-en
> łańcuchowa: butan, izobutan
>podstawienia (położenia grupy funkcyjnej) pentan-2-ol , pentan-1-ol)
-stereoizomeria (przestrzenna)
>optyczna ( enancjomery, diastereoizomery)
> geometryczna (cis-trans)
Ad.40 Izomeria cis-trans
Izomeria cis-trans to rodzaj izomerii przestrzennej charakterystycznej dla związków posiadających wiązania wielokrotne.
H H F H
\ / \ /
C = C C=C
/ \ / \
F F H F
Cis 1,2- difluoroeten trans 1,2-difluoroeten
Ad.41 Benzen
Ad.42 Węglowodory aromatyczne
Węglowodory aromatyczne to związki cykliczne charakteryzujące się tym, że posiadają pierścień aromatyczny powstały wskutek zdelokalizowanych elektronów tworzących orbitale połączone wiązaniami typu pi wewnątrz struktury węglowej połączonej wiązaniami sigma. Są to związki trwałe, ulegają reakcji substytucji elektrolitowej (nitrowanie, sulfonowanie, alkilowanie).
Ad.43 Kwasy karboksylowe
Kwasy karboksylowe są to związki zawierające grupe funkcyjną COOH powstające poprzez utlenienie aldehydów lub utlenienie mocnym utleniaczem alkoholu pierwszorzędowego. Reagują z zasadami dając sole oraz z alkoholami dając estry. Estry kwasów tłuszczowych ( wyższych kwasów karboksylowych) i gliceryny to tłuszcze. Sole sodowe lub potasowe wyższych kwasów karboksylowych to mydła. Przykłady:
-kwas mrówkowy HCOOH
-kwas masłowy CH3CH2CH2COOH < kwasy monokarboksylowe
- kwas szczawiowy < kwas dikarboksylowy
(COOH)2
Ad.44 Aminy
Aminy to pochodne związki amoniaku gdzie atom (lub atomy) wodoru z amoniaku zastępują np. grupy alkilowe.
W zależności ile atomów wodoru zostało zastąpionych przez takie grupy wyróżnia się:
-aminy I-rzędowe
R1
/
H-N
\
H
-aminy II-rzędowe
R1
/
H-N
\
R2
-aminy III-rzędowe
R1
/
R3 -N
\
R2
Ad.45 Ketony i aldehydy
Ketony są związkami o wzorze ogólnym:
R1- C- R2
||
O
Mniejsze ketony są cieczami polarnymi, słabo reaktywnymi, powstają poprzez odwodornienie alkoholi II-rzędowych
Aldehydy to związki o wzorze ogólnym
R1-C-H
||
O
Aldehydy są bardziej reaktywne od ketonów, łatwiej je utlenić ( do kwasów karboksylowych)
Powstają poprzez odwodornienie alkoholi I-rzędowych
Ad.46 Etery i związki cykliczne
Etery to związki o wzorze ogólnym R1-O-R2. Są to trwałe związki, mogą występować w złożonej postaci cyklicznej. Etery można otrzymać poprzez dehydratacje alkoholi.
Związki cykliczne to głównie związki organiczne, w których atomy wiążą się ze sobą tworząc pierścieniowe struktury. Gdy pierścień składa się z atomów jednego rodzaju jest to związek homocykliczny, a gdy z wielu rodzajów atomów to jest to związek heterocykliczny.
Ad.47 Dysocjacja elektrolityczna, stała dysocjacji
Dysocjacja elektrolityczna to rozpad na jony związków o wiązaniach jonowych lub silnie spolaryzowanych pod wpływem rozpuszczalnika np.wody. Ulegają jej sole, kwasy i wodorotlenki.
Stała dysocjacji to stężeniowy stosunek zdysocjowanych jonów i stężenia substratów
Dla dysocjacji A2B3 > 2A3+ +3B2- stała dysocjacji K = [A3+]2 [B2-]3 / [A2B3]
Ad.48 Dysocjacja wody, pH
2H2O > 2H+ +2OH- lub H2O +H2O > H3O+ + OH-
pH= -log[H+] lub -log[H3O+]
Ad.49 Indykatory
Indykatory to substancje zmieniające barwę w zależności od środowiska, w jakim się znajdują ( kwasowy, zasadowym czy obojętnym) np. oranż metylowy, fenoloftaleina.
Ad.50 Iloczyn rozpuszczalności
Iloczyn rozpuszczalności to iloczyn stężeń rozpuszczonych elektrolitów np.
IAg2S = [Ag+][S2-] .
Jest to, tak samo jak stała dysocjacji, wielkość bezwymiarowa np. 4,3*10-11-
Ad.51 Polielektrolity
Polielektrolity są to polimery, które w odróżnieniu od innych posiadają w swojej budowie jony. Dzieli się je na polikwasy, polizasady czy polisole. Są związkami rozpuszczalnymi w wodzie i dzięki swoim właściwością elektrycznym są używane do usuwania zawiesin z wody (filtracji), uzdatniania jej, stabilizowania emulsji, zagęszczania produktów spożywczych czy kosmetycznych.
Ad.52 Korozja żelaza
W stalowych materiałach łączy się żelazo z niewielkimi domieszkami węgla pod postacią grafitu lub węgliku żelaza. Niejednorodność chemiczna w budowie jest przyczyną niejednorodności w reakcji na elektrolit. Przy fragmentach grafitowych powstają mikroogniwa gdzie żelazo utlenia się, czyli ulega reakcji anodowej a tlen ulega redukcji do jonów OH-. Sumarycznie dojdzie więc do reakcji Fe +1/2O2 + H2O Fe(OH)2. Powstały wodorotlenek żelaza (II) ulega dalszemu utlenieniu w powietrzu tworząc uwodniony tlenek żelaza (III), który znany jest jako rdza.
Ad.53 Współczynniki stechiometryczne dowolnej reakcji
2CH3COOH + Ca(OH)2 (CH3COO)2Ca + 2H2O
Ad.54 Prawo zachowania masy, prawo działania mas
Prawo zachowania masy mówi o tym, że w odizolowanym środowisku (żaden reagent go nie opuszcza) podczas reakcji chemicznej masa substratów przed reakcją jest równa masie otrzymanych produktów. Wynika to z faktu, że podczas reakcji ilość atomów w układzie zamkniętym ani nie rośnie ani nie maleje
Prawo działania mas mówi o tym, że szybkość reakcji chemicznej jest proporcjonalna do stężeń reagentów. Reakcja chemiczna trwa do momentu, w którym iloczyn stężeń powstałych produktów do iloczynu substratów osiąga stałą wartości charakterystyczną dla danej reakcji w danych warunkach. Stała równowagi dla reakcji rozpadu wody:
2H2O 2H2 + O2 K=[H2]2[O2] / [H2O]2
Ad.55 Utlenianie i redukcja
Utlenianie to reakcja, w której dany reagent zwiększa swój stopień utlenienia, czyli oddaje elektron lub elektrony. Związek, który utlenia się jest nazywany reduktorem. Redukcja to reakcja, w której dany reagent zmniejsza swój stopień utlenienia. Związek który się redukuje nazywamy utleniaczem. Przeważnie utlenianiu towarzyszy w reakcji redukcja a proces ten zwany jest reakcją redoks. Np.
C +O2 CO2
Utlenianie: C0 C4+ + 4e-
Redukcja: O2 +4e- 2O2-
Ad.56 Energia wewnętrzna, pierwsza zasada termodynamiki
Energia wewnętrzna układu to suma ilości energii kinetycznych i potencjalnych, na które składają się ruch cząstek, energia ich drgań i zderzeń ( oddziaływania międzycząsteczkowe) oraz oddziaływanie elektronów z jądrem (oddziaływania wewnątrzcząsteczkowe). Energia wewnętrzna ma symbol „U”.
Pierwsza zasada termodynamiki to inaczej zasada zachowania energii. Prawo to mówi, że suma zmian energii wewnętrznych w układzie zamkniętym, na którą składa się ciepło i praca jest równa zero.
Q+W
Ad. 57 Entalpia
Entalpia to suma energii wewnętrznej i pracy objętościowej ( pracy potrzebnej do wytworzenia ciśnienia „p” w objętości „V”). --> H = U+ pV.
Pojęcie entalpii jest szczególnie przydatne do opisu procesów przebiegających pod stałym ciśnieniem, gdyż wtedy zmiana entalpii jest równoznaczna z ilością dostarczonego ciepła ->
.
Ad.58 Entropia
Entropia to stopień uporządkowania materii. Jest funkcją stanu, czyli funkcją zależną tylko od stanu początkowego i stanu końcowego reakcji a nie bezpośrednio przebiegu jej procesu. Entropia opisuje prawdopodobieństwo ukierunkowania reakcji spontanicznej, czyli przejścia jednego stanu w drugi bez ingerencji czynników zewnętrznych. Podczas takiego przejścia entropia zawsze rośnie. Jeżeli układ wymienia ciepło z otoczenia w sposób odwracalny to zmiana entropii odpowiada ilorazowi pobranego ciepła i temperatury ∆S = Q/T
Ad.59 Reakcje egzotermiczne i endotermiczne.
Reakcja egzotermiczna to reakcja, która emituje ciepło ( oddaje je do otoczenia). Reakcja endotermiczna to reakcja, która pochłania ciepło z zewnątrz.
Ad.60 Entalpia swobodna
Entalpia swobodna jest definiowana jako różnica entalpii oraz iloczynu temperatury bezwzględnej i entropii -> G= H- TS. Entalpia swobodna to ta część entalpii, którą można zamienić na pracę użyteczną.
Ad.61 Diagram energetyczny
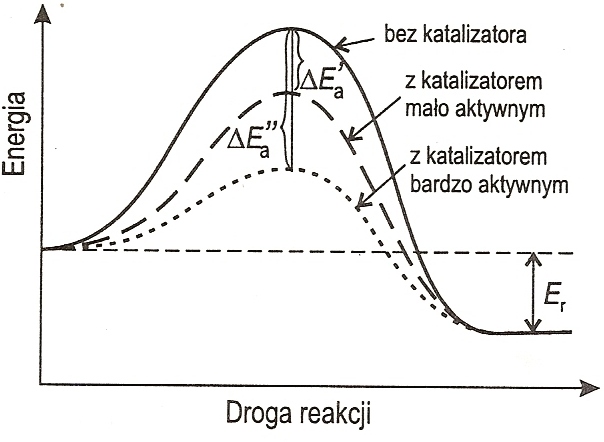
Gdzie ∆Ea to zmiana energii aktywacji a ∆Er to zmiana energii reakcji.
Ad.62 Reguła przekory
Reguła przekory mówi o tym, że układ znajdujący się w równowadze na który działa czynnik zewnętrzny odpowiada w ten sposób, aby przeciwdziałać temu czynnikowi. Praktyczne zastosowanie:
- jeśli objętość rośnie to ciśnienie maleje. Jeśli ciśnienie maleje to stężenie rośnie
- temperatura w regule przekory:
> reakcje egzotermiczne: temperatura rośnie - wydajność maleje ; temperatura maleje- wydajność reakcji rośnie ( wydajność reakcji rośnie gdy stała równowagi dynamicznej przesuwa się w stronę produktów)
> reakcje endotermiczne: temperatura rośnie - wydajność reakcji rośnie ; temperatura maleje - wydajność reakcji maleje.
-ciśnienie w regule przekory:
> w reakcjach, gdy objętościowo reagentów gazowych po stronie substratów jest więcej niż reagentów gazowych po stronie produktów ( np. 2H2 + O2 2H2O) 3obj. gazowe 0obj. gazowych:
ciśnienie rośnie - wydajność reakcji maleje ; ciśnienie spada - wydajność reakcji rośnie
>w reakcjach, gdy objętościowo reagentów gazowych po stronie substratów jest mniej niż reagentów gazowych po stronie produktów: ciśnienie rośnie- wydajność reakcji rośnie ; ciśnienie maleje - wydajność reakcji maleje
Ad.63 Surowce mineralne
Surowce mineralne można podzielić na:
- energetyczne ( np. węgiel, ropa)
-metale
-niemetale
-budowlane
Ad.64 10 minerałów
- hematyt, magnetyt, piryt (żelazo)
- chalkopiryt, chalkozyn, bornit (miedź)
- argentyt, chlorargyryt ( srebro)
-kalcyt, aragonit (wapń)
Ad.65 i 66 Mechanizmy wietrzenia chemicznego i przykłady
-rozpuszczanie (solucja) - głównie za pomocą wody, rozpuszczaniu ulegają zwykle wapienie, gipsy, chlorki oraz częściowo piaskowce, margle. Np. CaCO3 = Ca2+ + CO3 2-
- utlenianie - minerały łączą się z tlenem np. powstawanie siarczanów z siarczków np. otrzymanie limonitu z Fe2(SO4)3
-karbonatyzacja - przekształcenie minerałów w węglany ( minerały krzemianowe + kwas węglowy wodorowęglany metali z minerałów)
-hydroliza - rozkład zasadowy lub kwasowy minerałów (np. skaleń potasowy w hydrargilit)
-hydratacja - uwodnienie minerałów ( Fe2O3 (hematyt) 2 Fe2O3 *nH2O (limonit))
-ługowanie - wypłukiwanie minerałów ze skał do roztworów
Ad.67 Złoża okruchowe
Złoża okruchowe eluwialne powstają wskutek częściowego wypłukiwania materiału tworzącego złoże, co prowadzi do procentowego wzrostu składników użytecznych w pokładzie. Np. złoża cyrkonu, kasyterytu.
Złoża okruchowe aluwialne to złoża powstałe na skutek działalności płynących wód, która staje się czynnikiem selekcjonującym materiały pod względem masy okruchów. Nagromadzony materiał tworzy złoże aluwialne np. platyna, kasyteryt.
Złoża rezydualne powstają w wyniku przekształcenia chemicznego skały w wyniku intensywnego wietrzenia.
Złoża chemiczne powstają wskutek odparowania wody ze zbiornika i wytrącenia się i skrystalizowania minerałów np. sól kamienna, potasowa, gips.
Złoża biochemiczne powstają w skałach, w których istnieje znaczna ilość szczątków organicznych, które zostały zmodyfikowane chemiczne w odpowiednich warunkach np. węgiel kamienny, torf. << nie jestem pewien tego pytania.
Złoża ewaporacyjne -> tworzą je osady wytrącające się podczas szybkiego wyparowania zbiornika wodnego. Pytanie tylko czym to się rózni od złóż chemicznych.
Ad.68 Tworzywa sztuczne
-Polistyren ( styropian) - łatwopalny, spala się szybko kopcącym płomieniem i wydzielając zapach hiacyntów.
- Polietylen ( symbol przemysłowy PE ) - polimer etenu. Miękki, łatwopalny, pływa po wodzie, po spaleniu ma zapach parafiny, rozpuszcza się w tetra chlorku węgla
-polipropylen ( symbol przemysłowy PP) - polimer propenu. Twardszy od polietylenu, łatwopalny, po spaleniu ma zapach parafinym, rozpuszcza się w chlorobenzenie
- polimetakrylan metylu (pleksi) - szkło akrylowe, pali się wydzielając zapach zmywacza do paznokci
- polichlorek winylu (PCV) - twardy, paląc się wydziela chlorowodór
Ad.69 Polimeryzacja, poliaddycja, polikondensacja
Polimeryzacja to proces powstawania polimerów z małych cząstek zwanych merami bez wydzielenia produktów ubocznych. Zachodzi łańcuchowo
Poliaddycja to stopniowa polimeryzacja bez wydzielania produktów ubocznych. Tak powstają np. poliuretany
Polikondensacja to stopniowy proces syntezy polimerów z wydzieleniem produktów ubocznych w postaci małych cząstek np. wody. Tak powstają np. poliamidy
Ad.70 Polimery
Polimery to związki wielocząsteczkowe, które można otrzymać syntetyzując odpowiednie mery za pomocą np. katalizatora. W zależności od wielkości cząsteczkowej (ciężaru cząsteczkowego) poszczególnych merów, zmieniają się właściwości polimerów takie jak temperatura topnienia, wytrzymałość mechaniczna. W zależności od ilości merów użytych do syntezy polimeru wyróżnia się różne stopnie polimeryzacji. Oblicza się go dzieląc masę cząsteczkową polimeru przez masę pojedynczej cząsteczki. Stopień polimeryzacji również może wpływać np. na temperature topnienia czy odporność.
Ad.71 Sieciowanie polimerów
Większość polimerów posiada budowę łańcuchową, istnieje jednak możliwość że do łańcucha polimeru na skutek istnienia np. potrójnych wiązań zostaną przyłączone grupy poboczne. Grupy te reagując między sobą tworząc sieć trójwymiarową. Polimery usieciowione charakteryzują się nietopliwością i nierozpuszczalnością.
Ad.72 Wybuch
Wybuch to gwałtowny proces działający na zasadzie reakcji egzotermicznej i egzoenergetycznej powodujący wzrost ciśnienia i wywołanie fali uderzeniowej.
Ad.73 Podział wybuchów
W zależności od prędkości rozchodzenia się fali uderzeniowej wyróżnia się (od najwolniejszej do najszybszej)
-deflagracja (v <400m/s) . powstaje wskutek szybkiej reakcji utleniania
- eksplozja (400<v<1000m/s ) - wybuch właściwy ktorem towarzyszy huk
-detonacja (1000<v<8500m/s) -to wybuch przebiegający z maksymalną prędkością dla danego materiału wybuchowego. Towarzyszy jej huk i drgania
Ad.74 Reakcje podczas wybuchów
Nitrogliceryna
CH2-ONO2
|
2 CH -ONO2 6CO2 + 5H2O + NO + 5/2N2
|
CH2-ONO2
Trotyl
2C7H5N3O6 7CO +7C+5H2O + 3 N2
Ad.75 Rodzaje materiałów wybuchowych
- inicjujące ( materiały o słabej mocy detonacyjnej o dużej podatności na bodźce zewnętrzne, często stosuje się je jako pośredniczące pomiędzy materiałami o słabej podatności na bodźce zewnętrzne) np. piorunian rtęci
-kruszące (materiały o najgwałtowniejszej i najbardziej silnej detonacji) np. nitrogliceryna, trotyl
-miotające (to materiały powoli wybuchające, przy wybuchu produkują dużą ilość gazów) np. proch czarny, nitroceluloza)
-bezpieczne (materiały podczas wybuchu których nie towarzyszy płomień, używane w kopalniach gdzie istnieje zagrożenie gazami palnymi) np. metanity specjalne
-masy pirotechniczne (materiały o charakterystycznych wybuchach np. o dużym huku, błysku itd.)
Ad.76 Proch strzelniczy, saletra, proch bezdymny
Proch strzelniczy to materiał wybuchowy miotający używany w broni palnej. Najstarszym rodzajem prochu jest proch czarny, który spala się według uproszczonej reakcji:
2 KNO3 + S + 3 C → K2S + N2↑ + 3 CO2↑
Saletra to KNO3 (azotan potasu) stosuje się ją jako utleniacz w produkcji prochu czarnego.
Proch bezdymny to miotający materiał wybuchowy, który składa się z azotanu (V) celulozy i nitrogliceryny. Podczas wybuchu wydziela tylko bezbarwne gazy w postaci CO, CO2 i NO2
Ad.77 patrz pyt 75 oraz wzory w pyt 74
Ad.78 Materiały wybuchowe z grupy estrów z HNO3
- azotan (V) celulozy - nitroceluloza C6H7O11N3 ester celulozy i kwasu azotowego
- nitrogliceryna C3H5(NO3)3 ester gliceryny i kwasu azotowego. Związki silnie wybuchowe, łatwopalne, mało odporne na bodźce mechaniczne.
Ad.79 Nitrozwiązki aromatyczne
-trotyl > 2,4,6 trinitrotoluen C7H5N3O6 otrzymuje się poprzez nitrowanie toluenu. Trwały na czynniki mechaniczne, dzięki czemu bezpieczniejszy w użytkowaniu.
-kwas pikrynowy > 2,4,6 trinitrofenol, otrzymuje się go poprzez nitrowanie fenolu. Wybuchowy, używany w detonatorach.
Ad.80 Nitroaminy
- Heksogen (cyklotrimetylenotrinitroamina (CH2NNO2)3 )
- Tetrylit, 2,4,6-trinitrofenylo-N-metylonitroamina, (NO2)3C6H2NCH3NO2
- Oktogen (1,3,5,7-tetranitro-1,3,5,7-tetraazacyklooktan, C4H8N8O8)
- HNIW (2,4,6,8,10,12-heksanitro-2,4,6,8,10,12-heksaazaizowurtzitan, C6H6N12O12) jeżeli kogoś rajcują długie wzory to na wikipedii są szczegóły
Ad.81 Amonowo -saletrzane
-Azotan (V) amonu NH4NO3
Ad.82 Materiały chloranowe (-) i wapniowo-saletrzane (>)
- Chloran(V) potasu KClO3
- chloran (VII) potasu KClO4
-chloran (VII) amonu NH4ClO4
>azotan V wapnia Ca(NO3)2 z tym, że to bardziej nawóz niż materiał wybuchowy.
Ad.83 http://www.ig.pwr.wroc.pl/minproc/zpkio/student/Chemia/matwyb.pdf on to lubi
Ad.84 odpady komunalne
Ad.85 Samooczyszczanie
Najszybciej oczyszcza się powietrze, następnie wody a najdłużej gleby. Pani Szyszka w swoich slajdzikach zarzuciła konkretnym czasem oczyszczania, jak dla mnie to zależy od zanieczyszczenia.
Ad.86 Zanieczyszczenia powietrza
Głównymi związkami, które zanieczyszczają powietrze są dwutlenek siarki, tlenki azotu, tlenek i dwutlenek węgla, pyły, ołów. Źródłami są: przemysł, istnienie wielkich aglomeracji o dobrze rozwiniętej motoryzacji i produkujących wiele zanieczyszczeń komunalnych, wybuchy wulkanów.
Ad.87 http://www.imgw.pl/wl/internet/zz/klimat/0202_sklad.html
Ad.88 Zanieczyszczenia atmosfery pierwotne I wtórne
Zanieczyszczenia pierwotne to takie, które znajdują się w atmosferze w pierwotnej formie, czyli takiej w jakiej zostały wyemitowane.
Zanieczyszczenia wtórne to takie, które ulegają reakcjom ze stałymi związkami w atmosferze, np. utleniają się z tlenem atmosferycznym.
Ad.89 Efekt cieplarniany
To pytanie jest oklepane jak Pudzian :) Wikipedia dla tych co nie wiedzą
Ad.90 Zanieczyszczenia wód
Naturalne (np. sole z wód podziemnych)
Sztuczne ( nawozy sztuczne, pestycydy, kwasy, zasady, oleje, benzyny, bakterie, grzyby,
Źródła:
- punktowe miejsca, w których odprowadzane są ścieki komunalne lub w których fabryki przemysłowe odprowadzają zanieczyszczenia
- powierzchniowe zanieczyszczenia powstałe na skutek spłukiwania przez opady atmosferyczne zanieczyszczeń terenów zurbanizowanych nie posiadających odpowiednich systemów ściekowych lub terenów rolniczych i leśnych które używają nawozów sztucznych
NDS to odpowiednio unormowane największe dopuszczalne stężenie danego zanieczyszczenia w wodzie.
Ad.91 Woda
Największa gęstość przy 4 stopniach Celsjusza, wysoka reaktywność, właściwości rozpuszczalnika, obniżenie temperatury zamarzania przy wzroście ciśnienia, duża wartość napięcia powierzchniowego, wzrost objętości przy zamarzaniu, przewodnictwo elektryczne, tworzenie asocjatów, punkt potrójny.
Ad.92 Twardość węglanowa i niewęglanowa
Twardość całkowita to suma twardości węglanowych i niewęglanowych.
Twardość węglanową powodują wodorowęglany wapnia i magnezu, twardość niewęglanową powodują inne sole wapnia i magnezu np. CaSO4 czy MgSO4
Jednostki twardości wody:
-stopnie niemieckie 1°n = 10,00 mg CaO w 1 litrze wody oraz 1°n = 17,86 mg CaCO3 w 1 litrze wody
-stopnie francuski 1°f = 10,00 mg CaCO3 w 1 litrze wody
-milivale 1mval = 0,5 milimola jonów Ca2+ i 1 mval = 50mg CaCO3 w litrze wody
Ad.93 Zapotrzebowanie na tlen
Chemiczne zapotrzebowanie na tlen (ChZT5)) to miara stosowana do określenia zanieczyszczenia w wodzie. Oznacza ilość tlenu w mg/dm3 pobranego z utleniaczy na utlenienie związków do najwyższych stopni utlenienia
Biochemiczne zapotrzebowanie na tlen (BZT5) to miara stosowana do określenia zanieczyszczenia w wodzie. Oznacza ilość tlenu wymaganą do utlenienia związków przez mikroorganizmy. Otrzymuje się wartość w pomiarach trwających 5 dni i pośrednio określa stężenia substancji podatnej na rozłożenia przez mikroorganizmy
Ad.94 Kwaśne deszcze
Opady o pH poniżej 5,6 spowodowane obecnością dwutlenku siarki, tlenków azotu , chlorowodoru lub siarkowodoru w opadzie atmosferycznym. Substancje dostają się do opadu poprzez atmosferę, która wchłania wyżej wymienione gazy wyemitowane głównie poprzez spalanie paliw, przemysł, wulkany.
Ad.95 Toksyczność metali ciężkich
Metale ciężkie: selen, nikiel, kadm, arsen, miedź, cynk, chrom, rtęć, glin
Ich toksyczność polega na zdolności kumulowania się w organizmie np. w kościach (ołów), nerkach(rtęć), układzie nerwowym ( ołów, rtęć, glin), wątrobie (kadm)
Ad.96 Ogólna charakterystyka metali ciężkich
Termin metali ciężkich używany jest do opisu metali o dużej gęstości i często mającymi właściwości toksyczne dla organizmu. Głównymi źródłami metali ciężkich jest przemysł, dlatego pracownicy tych fabryk są szczególnie narażeni na zatrucie. Dodatkowo bardzo niebezpiecznym metalem jest ołów, który gromadzi się w kościach wcześniej wchłonięty w wyniku spalania paliw zawierających ten pierwiastek.
Ad.97 Magnez
Magnez reguluje wiele czynności życiowych, jest składnikiem kości i mięśni szkieletowych, utrzymuje odpowiednie ciśnienie osmotyczne krwi i tkanek, reguluje prace serca. Niedobór magnezu powoduje skurcze mięśni łydek, kołatanie serca, zawroty głowy, problemy z koncentracją, rozdrażnienie, wzmożenie wypadania włosów, łamliwe paznokcie, próchnicę zębów, mdłości.
Ad.98 Zanieczyszczenia izotopami promieniotwórczymi
Skażenie środowiska radioizotopami jest destrukcyjne dla wszelkich form życia. Mogą dostać się do środowiska w wyniku wybuchu reaktora jądrowego, wybuchu bomby wodorowej czy niewłaściwego składowania odpadów promieniotwórczych.
Ad.99 Jednostki SI
Nazwa |
Jednostka |
Wielkość fizyczna |
Kilogram |
kg |
masa |
Metr |
m |
długość |
Sekunda |
s |
czas |
Kelwin |
K |
temperatura |
Paskal |
Pa |
ciśnienie |
Mol |
mol |
Liczność materii |
Dżul |
J |
Praca, energia |
Amper |
A |
Natężenia pola elektrycznego |
Ad.100 Pytanie dowolne
Wyszukiwarka
Podobne podstrony:
5268
5268
5268
5268
5268
5268
5268
5268
więcej podobnych podstron