Gdańsk, 12.10.13
Grupa: czwartek 8:15
Sieracka Karolina
Pietrzak Kornel
Radomski Przemysław
Sokołowska Agata
SPRAWOZDANIE
Badanie właściwości związków barwnych z wykorzystaniem spektrofotometrii UV-VIS
1. Wykonanie ćwiczenia. (Karolina Sieracka)
Naszym zadaniem na zajęciach laboratoryjnych było wykonanie widm 11 roztworów zieleni bromokrezolowej oraz dwóch wybranych przez nas wskaźników. Roztwór zieleni bromokrezolowej o stężeniu 1x10-4 mol/dm3 został wcześniej przygotowany przez prowadzącego zajęcia.
Przygotowanie roztworów do badania widm:
1. Roztwór wskaźnika zawierający jego formę zdysocjowaną: 5ml zieleni bromokrezolowej, 5ml HCl(0,1M)
2. Roztwór wskaźnika zawierający formę niezdysocjowaną: 5ml zieleni bromokrezolowej, 5ml NaOH(0,1M)
3-11. Roztwory zawierające 5ml roztworu zieleni bromokrezolowej, 20ml kwasu octowego(0,1M) i kolejno 2,4,6,8,10,12,14,16,18 ml roztworu wodorotlenku sodu(0,1M).
Następnie przeszliśmy do badania widm tych roztworów w dwuwiązkowym spektrofotometrze UV-VIS.
Kolejnym zadaniem było praktyczne zapoznanie się z pojęciem barw dopełniających. Posiłkując się trójkątem barw(lub kołem barw) mieszaliśmy barwy podstawowe z barwami dopełniającymi i obserwowaliśmy efekty.
Następnie wybraliśmy 2 wskaźniki: czerwień kongo, błękit metylenowy, aby wykonać analizę widm.
2. Wyznaczanie wartości stałej dysocjacji zieleni bromokrezolowej na podstawie 3 doświadczeń + oznaczenie niepewności. (Porównanie z wartościami literaturowymi z wiarygodnego źródła i dyskusja wyników) (Kornel Pietrzak)
Poniższy wykres przedstawia na sposób graficzny wyniki doświadczenia.
Punkt izozbestyczny: 510 nm; A=0,044
Wykonano obliczenia i ich wyniki przedstawiono w poniższych tabelach.
A Hln= |
0,162 |
0,1M HCl |
|
|
|
A ln-= |
0,004 |
0,1M NaOH |
|
|
|
c0= |
0,00001 |
mol/dm3 |
|
λ [nm]= |
450 |
V NaOH [mL] |
pH |
A |
c Hln |
c ln- |
pK |
2 |
3,805757 |
0,143 |
8,79747E-06 |
1,20253E-06 |
4,670019 |
4 |
4,15794 |
0,136 |
8,35443E-06 |
1,64557E-06 |
4,863541 |
6 |
4,392023 |
0,104 |
6,32911E-06 |
3,67089E-06 |
4,628595 |
8 |
4,583909 |
0,103 |
6,26582E-06 |
3,73418E-06 |
4,808692 |
10 |
4,76 |
0,086 |
5,18987E-06 |
4,81013E-06 |
4,793 |
12 |
4,936091 |
0,068 |
4,05063E-06 |
5,94937E-06 |
4,769143 |
14 |
5,127977 |
0,055 |
3,22785E-06 |
6,77215E-06 |
4,806163 |
16 |
5,36206 |
0,038 |
2,1519E-06 |
7,8481E-06 |
4,800117 |
18 |
5,714243 |
0,017 |
8,22785E-07 |
9,17722E-06 |
4,666818 |
|
|
|
|
średnia: |
4,756232 |
|
|
|
|
|
|
A Hln= |
-0,015 |
0,1M HCl |
|
|
|
A ln-= |
0,312 |
0,1M NaOH |
|
|
|
c0= |
0,00001 |
mol/dm3 |
|
λ [nm]= |
590 |
V NaOH [mL] |
pH |
A |
c Hln |
c ln- |
pK |
2 |
3,805757 |
0,009 |
9,26606E-06 |
7,33945E-07 |
4,906989 |
4 |
4,15794 |
0,04 |
8,31804E-06 |
1,68196E-06 |
4,852146 |
6 |
4,392023 |
0,099 |
6,51376E-06 |
3,48624E-06 |
4,663498 |
8 |
4,583909 |
0,097 |
6,57492E-06 |
3,42508E-06 |
4,867129 |
10 |
4,76 |
0,136 |
5,38226E-06 |
4,61774E-06 |
4,826536 |
12 |
4,936091 |
0,169 |
4,37309E-06 |
5,62691E-06 |
4,826609 |
14 |
5,127977 |
0,197 |
3,51682E-06 |
6,48318E-06 |
4,862339 |
16 |
5,36206 |
0,241 |
2,17125E-06 |
7,82875E-06 |
4,805078 |
18 |
5,714243 |
0,28 |
9,78593E-07 |
9,02141E-06 |
4,74957 |
|
|
|
|
średnia: |
4,817766 |
|
|
|
|
|
|
A Hln= |
-0,009 |
0,1M HCl |
|
|
|
A ln-= |
0,179 |
0,1M NaOH |
|
|
|
c0= |
0,00001 |
mol/dm3 |
|
λ [nm]= |
560 |
V NaOH [mL] |
pH |
A |
c Hln |
c ln- |
pK |
2 |
3,805757 |
0,004 |
9,30851E-06 |
6,91489E-07 |
4,934852 |
4 |
4,15794 |
0,022 |
8,35106E-06 |
1,64894E-06 |
4,862478 |
6 |
4,392023 |
0,055 |
6,59574E-06 |
3,40426E-06 |
4,679265 |
8 |
4,583909 |
0,055 |
6,59574E-06 |
3,40426E-06 |
4,87115 |
10 |
4,76 |
0,076 |
5,47872E-06 |
4,52128E-06 |
4,843418 |
12 |
4,936091 |
0,095 |
4,46809E-06 |
5,53191E-06 |
4,843337 |
14 |
5,127977 |
0,112 |
3,56383E-06 |
6,43617E-06 |
4,871266 |
16 |
5,36206 |
0,138 |
2,18085E-06 |
7,81915E-06 |
4,807527 |
18 |
5,714243 |
0,161 |
9,57447E-07 |
9,04255E-06 |
4,739066 |
|
|
|
|
średnia: |
4,82804 |
|
|
|
średnia z 3 doświadczeń: |
4,800679 |
|
Graficznie (kolejno):4,80; 4,82; 4,84
Analitycznie:
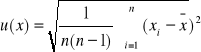
u(x)= 0,01550038
pK=4,801±0,015
wartość literaturowa: pK=4,9 [298K, 101325Pa]
źródło: W. Mizerski Tablice chemiczne Wydawnictwo Adamantan, Wydanie IV zaktualizowane, Warszawa 2004
Uzyskany wynik ma wartość praktyczną, jednak odbiega od wartości literaturowej. Na podstawie niepewności widać, że metoda ma duży potencjał, ponieważ jest precyzyjna. Natomiast uzyskaliśmy małą dokładność. Przyczyny tego mogą być następujące:
- roztwory, w szczególności wskaźnika nie zostały dokładnie przygotowane (całkiem prawdopodobne)
- badana substancja nie spełnia idealnie pierwotnych założeń (np. asocjuje, nie dysocjuje w założony sposób)(mało prawdopodobne)
3. Wskaźniki jedno- i dwubarwne
a) Obserwacja zabarwienia wskaźników, zaproponowanie maksimum absorpcji i wskazanie barw dopełniających.(Karolina Sieracka)
Wrażenie barwy tworzy się poprzez odbicie od przedmiotu nie pochłoniętych fragmentów widma światła białego (światło białe po rozszczepieniu daje paletę barw). Promieniowanie odbite, które nie zostało zaabsorbowane przez obiekt daje nam światło barwne.
Czerwień kongo jak sama nazwa wskazuje ma barwę czerwoną, barwą dopełniającą do barwy czerwonej jest zielony, spodziewane maksimum absorpcji wyznaczamy 490-500nm.
Błękit metylenowy ma jasnoniebieskie zabarwienie, barwą dopełniającą do tej barwy jest żółty lub żółtopomarańczowy, więc spodziewane maksimum absorpcji będzie w zakresie 580-605nm.
b) Rejestracja widm UV-VIS dwóch wybranych wskaźników - czerwień kongo i błękit metylenowy (Karolina Sieracka)
Na podstawie analizy widma czerwieni Kongo widzimy, że maksimum absorpcji przypada w zakresie 495-500nm, co zgadza się z wcześniejszym założeniem.
Analiza widma błękitu metylenowego nie jest jednoznaczna. Na wykresie widzimy że pik nie jest jednolity- rozwarstwia się. Maksimum absopcji przypada w zakresie 615-660nm. W tym zakresie barwą widzialną powinnien być zielono-niebieski, dlaczego skoro próbce bliżej było do błekitnego?
Pomocna w odpowiedzi może być budowa wskaźnika. Jak wiemy błękit metylenowy czyli chlorek 3,7-bis(dimetyloamino)feno-5-tioazynowy jest wskaźnikiem dwubarwnym. W roztworach kwaśnych barwi się na zielono, a w obojętnych i zasadowych daje barwę od błękitnej do granatowej. Wskaźnik był roztworem wodnym bazującym na wodzie destylowanej, której pH powinno być obojętne. Lekka kwasowość roztworu daje nam widoczny na wykresie obraz widma.
c) Obserwacja zabarwienia bezwodnego CuSO4 w stanie suchym i w roztworze wodnym oraz zmiana jego barwy po dodaniu roztworu amoniaku. (Przemysław Radomski)
Bezwodny siarczan miedzi (II) jest koloru białego. Po zmieszaniu go z wodą tworzą się hydraty. Siarczan miedzi może występować w formie mono-, tri- lub pentahydratu. Pentahydrat zarówno w formie suchej jak i roztworu wodnego wykazuje niebieskie zabarwienie.
Na laboratorium dysponowaliśmy roztworem wodnym CuSO4x5H2O. Jego kolor był bladoniebieski, ze względu na dość duże rozcieńczenie. Po dolaniu do probówki z siarczanem wodnego roztworu amoniaku kolor stał się bardziej intensywny, można nawet zaryzykować stwierdzenie, że ciemnoniebieski. Poniżej wytłumaczenie tego faktu
Miedź jest metalem o następującej strukturze elektronowej:
Cu: 1s22s22p63s23p64s13d10
Cu2+: 1s22s22p63s23p64s03d94p0
Jak widać możliwe jest utworzenie 4 wiązań koordynacyjnych (tworzy się orbital sp3 całkowicie nieobsadzony elektronami) między atomem metalu (kwas Lewisa, akceptor elektronów) a ligandem (zasada Lewisa, donor elektronów). Wytworzenie wiązań tłumaczy pośrednio pochłanianie przez ten związek energii promieniowania fal z zakresu długości światła widzialnego. Pochłanianie to jest możliwe dzięki przeskokom elektronów na inne poziomy energetyczne, oddalone od aktualnego poziomu o energię, która może być dostarczona przez fale z zakresu widzialnego. Zależności te wynikają z podstawowych praw fizyki i również dzięki nim możemy obliczyć energię czy długość danej fali:
![]()
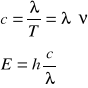
Wrażenie koloru, to odbiór barwy dopełniającej do barwy, której odpowiada pochłaniana energia fali o danej długości. Jeżeli obserwujemy kolor niebieski, oznacza to, że pochłaniana jest fala o długości 590-635nm co odpowiada barwie pomarańczowej. Zmiana intensywności barwy wynika z wytworzenia bardziej trwałego kompleksu amokanialnego.
Wyszukiwarka
Podobne podstrony:
polar i uv-vis, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
PODCHLORYN, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok, Sprawozdania
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
Zadania na rozgrzewke, Technologia chemiczna PWR, SEMESTR IV, Obliczenia w chemii technicznej
Dulcyna, Płyta farmacja Poznań, IV rok, technologia chemiczna, ćwiczenia
ZASADY UDZIELANIA PIERWSZEJ POMOCY W NAGŁYCH WYPADKACH, Płyta farmacja Poznań, IV rok, technologia c
Pytania z chemicznego utrwalania, SGGW TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIE CZŁOWIEKA, IV Semestr, OTŻ
wyjście, Płyta farmacja Poznań, IV rok, technologia chemiczna, ćwiczenia
ZASADY BEZPIECZEŃSTWA I HIGIENY PRACY, Płyta farmacja Poznań, IV rok, technologia chemiczna, ćwi
paracetamol, Płyta farmacja Poznań, IV rok, technologia chemiczna, ćwiczenia
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Wejściówka, Płyta farmacja Poznań, IV rok, technologia chemiczna, ćwiczenia
zagadnienia 24, Technologia chemiczna PWR, SEMESTR IV, Przetwórstwo i właściwości polimerów
pyt OTŻ, SGGW TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIE CZŁOWIEKA, IV Semestr, OTŻ
Pytanka opisowe z dyspersji, SGGW TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIE CZŁOWIEKA, IV Semestr, OTŻ
więcej podobnych podstron