POLITECHNIKA WROCŁAWSKA INSTYTUT FIZYKI
|
Sprawozdanie z ćwiczenia nr 24 |
Konrad Piątkiewicz
|
TEMAT: Wyznaczanie ciepła topnienia lodu. |
Wydział: Mech. MiBM Rok: 3 sem.V
|
DATA: 21.10.1996 OCENA: |
Cel ćwiczenia:
Zapoznanie się z techniką pomiarów kalometrycznych oraz ocena dokładności tych pomiarów.
Część teoretyczna ( opis zjawiska fizycznego ).
Mierzeniem ilości ciepła zajmuje się dział nauki o cieple, zwany kalorymetrią. Kalorymetria opiera się na kilku zasadach, które można wyrazić następująco:
- ilość ciepła ![]()
oddana przez ciało badane jest równa ilości ciepła ![]()
pobranej przez ciała otaczające;
- ilość ciepła pobrana przez ciało podczas ogrzewania jest równa ilości ciepła oddanej podczas ostygania w tym samym zakresie temperatur jeśli ciało przechodzi w odwrotnym porządku przez te same stany pośrednie;
- ilość ciepła Q oddana bądź pobrana przez ciało jednorodne jest proporcjonalna do jego masy, a przy niewielkich zmianach temperatury - do przyrostu temperatury ![]()
.
Ciepłem topnienia nazywamy ilość ciepła potrzebną do zamiany 1 kg ciała stałego
o temperaturze topnienia na ciecz o tej samej temperaturze.
Ilość ciepła Q potrzebna do stopienia masy m ciała o temperaturze topnienia wyraża się wzorem ![]()
, gdzie ![]()
- ciepło topnienia.
Temperatura topnienia T zależy od ciśnienia, przy którym zachodzi przemiana ciała stałego
w ciecz.
Część doświadczalna (pomiary dokonano 2x):
Kalorymetr wodny:
- Po zważeniu na wadze laboratoryjnej pustego suchego naczynia kalorymetrycznego wraz
z mieszadłem, napełniono 2/3 obj. wodą destylowaną i ponownie zważono.
- Po wstawieniu naczynia do kalorymetru i zanurzeniu termometru, przez ok. 5min odczytywano temperaturę.
TABELA 1 (pomiar1)
czas[min] |
temp.[C] |
1 |
23,5 |
2 |
23,5 |
3 |
23,6 |
4 |
23,5 |
5 |
23,45 |
- Po otworzeniu kalorymetru, wsypaniu drobno potłuczonego lodu (1/4 obj.), mieszając wodę odczytywano temperaturę co 1015s.
TABELA 2 (pomiar1)
czas[s] |
temp.[C] |
15” |
18 |
30” |
17 |
45” |
16,1 |
1'00” |
14,8 |
1'15” |
13,3 |
1'30” |
12,6 |
1'45” |
12,2 |
2'00” |
12,1 |
2'15” |
11,95 |
3'15” |
12,15 |
4'15” |
12,6 |
5'15” |
12,8 |
6'15” |
13 |
7'15” |
13,2 |
- Zważono naczynie kalorymetryczne.
TABELA 3 (pomiar1)
masa naczynia |
130,65g |
masa naczynia z woda |
192,2g |
masa wody |
61,55g |
masa naczynia z wodą+lód |
206,7g |
masa lodu |
14,5g |
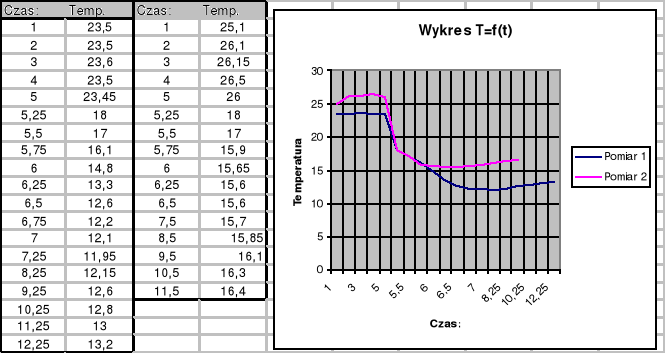
Sporządzenie wykresu T=f(t):
Pomiar 1 : Pomiar 2 :
Część obliczeniowa :
Wartości stałe:
Oznaczenia jakie przyjąłem:
CX ciepło topnienia lodu
mL masa lodu
CW ciepło właściwe wody
mW masa wody w kalorymetrze
CK ciepło właściwe kalorymetru
mK masa kalorymetru z mieszadełkiem
R objętościowe ciepło właściwe szkła i rtęci
V objętość zanurzonej części termometru
TW temperatura początkowa wody w kalorymetrze
TK temperatura końcową układu
TT temperatura topnienia lodu równa 273.15 K
Wyznaczenie ciepła topnienia lodu z równania bilansu cieplnego:
Po podstawieniach:
![]()
![]()
![]()
![]()
![]()
Otrzymałem:
![]()
Teraz mogę wyliczyć ciepło topnienia lodu Cx :
![]()
Błąd Cx obliczę z różniczki zupełnej:
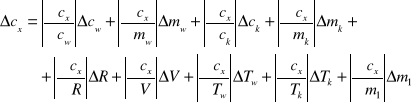
Wartości jakie przyjąłem do obliczeń:
mL = 0,0145 kg mL = 0.000 02 kg
CW= 4185 J/kg K CW = 8 J/kg K
mW = 0,06155 kg mW = 0.000 02 kg
CK = 879 J/kg K CK = 1 J/kg K
mK = 0,13065 kg mK = 0.000 01 kg
R = 1 930 000 J/m3 K R = 80 000 J/m3 K
V = 0.000 000 25 m3 V = 0.000 000 02 m3
TW = 296,5 K TW = 0.2 K
TK = 286,2 K TK = 0.2 K
Tt = 273.15 K
Z obliczeń:
Cx = 320 541.7584 J/kg
Cx = 12 453.92341 J/kg
Ostatecznie Cx=(320 500 +-12 500) J/kg
Błąd względny : ![]()
Wnioski :
Celem ćwiczenia było zmierzenie ciepła topnienia lodu. Pomiary dały wynik 320500 J/kg. Wartość ciepła topnienia podawana w tablicach fizycznych wynosi 340000 J/kg. Błąd bezwzględny wyniku to 12453 J/kg co jest spora wartością, lecz jako błąd względny daje ostatecznie 3.88 % (myślę, ze jest to nieźle).
Na wykresie topnienia (na papierze milimetrowym) widać, ze charakterystyka jest "zaokrąglona", nie ma tam kątów ostrych (teoretycznie - bez uwzględniania warunków praktycznych pomiaru powinny być ostre). Wynika to z bezwładności cieplnej wszystkich elementów biorących udział praktycznie w wymianie ciepła, wiec : kalorymetr, woda, termometr, mieszadełko kalorymetru, powietrze w kalorymetrze i poza nim, stół na którym stal kalorymetr. Największy wpływ na zaokrąglenie charakterystyki miały czynniki bezpośrednio stykające się z lodem. Pomiar ciepła topnienia lodu był pośredni (nie można zmierzyć tego bezpośrednio - należy wyliczyć ze wzoru). W związku z tym, że wzór był dość rozbudowany i składał się z wielu zmiennych. Na błąd pomiaru wpływało wiele czynników takich jak :
dokładność pomiaru mas (kalorymetru, kalorymetru z woda, kolorymetru z woda i lodem)
dokładność pomiaru objętości pojemniczka z rtęcią w termometrze
dokładność pomiaru temperatury w rożnych chwilach
Spośród tych rożnych przyczyn największy wpływ na błąd miały : dokładność pomiaru temperatury końcowej całego układu i dokładność pomiaru temperatury początkowej wody w kalorymetrze. Generalnie na błędy najbardziej wpłyną pomiar temperatury.
2
ciepło właściwe wody Cw=
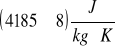
pojemność cieplna właściwa zbiornika z rtęcią termometru
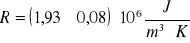
ciepło właściwe kalorymetru:
aluminiowego
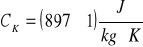
mosiężnego
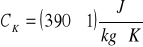
miedzianego
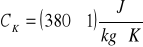
szklanego
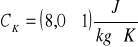
Wyszukiwarka
Podobne podstrony:
Cw88fiz, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
CW84FIZ, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
sprawko 5, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
cw 6 W1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizy
cw 5 wyk2, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
Cw 4D, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizyka
laborka 3, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fi
cw 7 W1b, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
cwiczenie 25 FIZYKA H1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, f
cwiczenie 43 FIZYKA H1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, f
MOJ-LAB7, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
FIZYKA~4, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fiz
plan, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizyka
fiz56, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, fiza kalit, fizyka
więcej podobnych podstron