1.PLANETARNY MODEL ATOMU BOHRA
Zgodnie z modelem Rutherforda cały dodatni ładunek atomu i cała jego masa jest skupiona w jądrze, wokół, którego po orbicie krąży elektron tworząc powłokę elektronową. Atom jest elektrycznie obojętny, czyli liczba elektronów jest taka, że dodatni ładunek jądra jest równoważony przez ujemny ładunek elektronu
Postulaty Boh ra
Elektron w atomie może przebywać tylko w pewnych stanach o określonej energii zwanych stanami stacjonarnymi
W stanie stacjonarnym elektron nie traci energii. Przechodząc ze stanu o wyższej energii do niższej emituje on kwant energii zaś przechodząc ze stanu o niższej energii do wyższej pobiera kwant energii
Elektron w atomie wodoru może krążyć tylko po takich orbitach, dla których jego moment pędu jest całkowitą wielokrotnością stałej Plancka podzielonej przez 2 pi p=
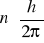
W każdym dozwolonym stanie elektron porusza się wokół jądra po orbicie kołowej
2. FALOWY MODEL ATOMU
Jeżeli elektron jest falą okrążającą jądro to może on się poruszać tylko po takim torze, na którym będzie falą stojącą, gdyż w każdym innym przypadku długi ciąg falowy nakładający się wielokrotnie na siebie sam by przez interferencję uległ wygaszeniu, co zaprzeczałoby istnieniu elektronu
mvr = ![]()
- jest to pierwszy postulat Bohra
Elektron jest falą, więc określenie jego dokładnego położenia jest niemożliwe można tylko określić prawdopodobieństwo jego położenia w danym punkcie
Równanie Schredingera energia atomu = energia potencjalna + energia kinetyczna elektronu
3. LICZBY KWANTOWE
Główna liczba kwantowa - kwantuje energię elektronu jest równa numerowi orbity, na której znajduje się elektron n = 1, 2, 3, 4…
Orbitalna liczba kwantowa określa wartość orbitalnego momentu pędu elektronu. Przyjmuje wartości liczb całkowitych, określa kształt poszczególnych orbitali np. dla n = 1 l = 0 dla n = 2 l = 0, 1
Magnetyczna liczba kwantowa kwantuje orientację wektora orbitalnego momentu pędu elektronu względem wyróżnionego kierunku wektora indukcji pola magnetycznego przyjmuje wartości
-l, -l+1,0, l-1, l
4. Spinowa liczba kwantowa s = ![]()
kwantuje orientację własnego momentu pędu elektronu (określa kierunek obrotu elektronu wokół własnej osi)
Zakaz Pauliego w atomie nie mogą być elektrony, które mają wszystkie cztery liczby kwantowe takie same
5.KOLEJNOŚĆ ZAPEŁNIANIA POWŁOK ELEKTRONOWYCH
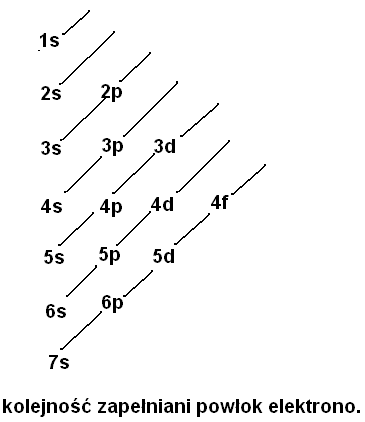
n |
Liczba elektronów max |
Liczba powłok |
1 |
s2 |
2 |
2 |
s2 p6 |
8 |
3 |
s2 p6 d 10 |
18 |
4 |
s2 p6 d 10 f14 |
32 |
6. NAPISZ STRUKTURE ELEKTRONOWA WYBRANEGO PIERWIASTKA
Np. dla fosforu
1s2,2s2,2p6,3s2,3p3
arsenu
1s2,2s2,2p6,3s2,3p6,3d10, 4s2,4p3
7. BUDOWA UKŁADU OKRESOWEGO PIERWIASTKÓW
Układ okresowy został podzielony na poziome okresy i pionowe grupy. Grupy są podzielone na główne A i poboczne B. Numer grupy odpowiada ilości elektronów walencyjnych w atomach pierwiastków będących w tej same grupie a więc maksymalnej wartościowości pierwiastków. W obrębie grupy w miarę wzrostu liczby atomowej (od góry do dołu) rosną właściwości metaliczne pierwiastków. W obrębie okresu w miarę wzrostu liczby atomowej (z lewej do prawej) maleją właściwości metaliczne pierwiastków. Numer okresu odpowiada liczbie powłok elektronowych atomów pierwiastka danego okresu.
Pierwiastki w układzie okresowym uszeregowane są w miarę wzrostu liczby atomowej
Si 14 - liczba protonów w jądrze liczba atomowa
23,05 - liczba atomowa - liczba protonów i neutronów w jądrze
RODZAJE ENERGI W CZĄSTECZCE
Energia translacji jest to energia ruchu postępowego Energia kinetyczna. Wzrasta ona proporcjonalnie do temperatury
Energia rotacji jest to energia ruchu obrotowego cząsteczki
Energia oscylacji jest to energia drgań atomów tworzących wiązania drgania te powodują rozciąganie i deformacje wiązania atomowego
Energia elektronowa jest to energia, która wyzwala się na skutek oddziaływania elektronów tworzących wiązanie chemiczne z jądrami atomów
9, 10, 11. RODZAJE WIĄZAŃ W CZĄSTECZCE
Wiązania jonowe powstają między atomami pierwiastków różniących się znacznie elektroujemnością. Atom o niskiej elektroujemności oddaje jeden lub więcej elektronów a atom o wyższej elektroujemności pobiera te elektrony. Powstają wówczas jony o przeciwnych znakach, które przyciągają się tworząc wiązanie jonowe. Substancje połączone wiązaniem jonowym dobrze przewodzą prąd dobrze się rozpuszczają i są bardzo twadre np. Na+ + Cl-
Wiązania kowalencyjne atomowe powstają między atomami pierwiastków o tych samych elektroujemnościach. Atomy uwspólniają elektrony tworząc wiązania atomowe. Substancje z tymi wiązaniami nie przewodzą prądu i nie rozpuszczają się np. F2 H2O CH4 NH3
Wiązania koordynacyjne jest to odmiana wiązania kowalencyjnego, w którym wspólna para elektronów pochodzi od jednego z atomów tworzących wiązanie. Doner jest to atom oddający elektrony a akcepter jest to atom pobierający elektrony
Wiązanie spolaryzowane powstają w atomach o różnych elektroujemnościach. Atom pierwiastka o większej elektroujemności silniej przyciąga wspólną, parę elektronów będącą na orbitalu wiążącym. Jest to wiązanie pośrednie między wiązaniem kowalencyjnym a jonowym np. HCl
Wiązania metaliczne w atomach oddziaływujących ze sobą metali elektrony nie tworzą wspólnych par, lecz tworzą tak zwaną chmurę elektronową, w której są zanurzone dodatnie jony metalu tworząc sieć krystaliczną. Te dodatnie jony przyciągają elektrony tak, że nie mogą one opuścić metalu bez dostarczenia energii z zewnątrz
Wiązania wodorowe powstają w wyniku przyciągania dodatniego protonu przez dwa silnie elektroujemne atomy bogate w elektrony. Wiązanie to występuje w cząsteczkach H—Y gdzie y atom silnie elektroujemnego pierwiastka (O2, N, F, Cl). Przykładem wiązań wodorowych są wiązania miedzy cząsteczkami wody( są to słabe wiązania) lub też wiązania miedzy kwasem mrówkowym
12. ISTOTA HYBRYDYZACJI
Hybrydyzacja jest to mieszenie orbitali elektronów walencyjnych najczęściej o tej samej głównej liczbie kwantowej, lecz różnych pobocznych liczbach kwantowych. W wyniku hybrydyzacji powstają orbitalne o innym rozkładzie przestrzennym niż orbitalne wyjściowe. Liczba orbitali hybrydyzowanych jest równa liczbie orbitali wyjściowych
13. NARYSUJ ORBITALE I WIĄZANIA W HYBRYDYZACJI SP, SP2, SP3
|
Hybryda sp
|
Hybryda sp2
|
Hybryda sp3
|
14. OMÓW WIĄZANIA SIGMA ORAZ PI
Wiązanie σ - wiązanie chemiczne powstałe w wyniku nakładania czołowego orbitali atomowych. Kształt wiązania σ wyznacza orbital molekularny σ. Przy opisie wiązania σ w indeksie dolnym lub po spacji podaje się, jakie orbitale tworzą dane wiązanie, np.: σsp-sp, σsp2-sp, σsp3-s, σp-p*, σs-s, gdzie * oznacza orbital antywiążący.
Schemat powstawania orbitalu wiążącego σp-p
Wiązanie π - wiązanie chemiczne powstałe w wyniku nakładania bocznego orbitali atomowych (oprócz s). Kształt tego wiązania wyznacza orbital molekularny π. Przy opisie wiązania π w indeksie dolnym lub po spacji podaje się jakie orbitale tworzą dane wiązanie, np. πd-d, πp-p*, gdzie * oznacza orbital antywiążący.
|
Schemat powstawania wiążącego orbitalu πp-p
|
Schemat powstawania antywiążącego orbitalu πp-p* |
Orbital wiążący πp-d
|
|
|
|
15. SCHARAKTERYZUJ WIĄZANIE METALICZNE
Wiązanie metaliczne - ogólna nazwa dla wszelkich wiązań chemicznych występujących bezpośrednio między atomami metali.
Wiązania między atomami metalu, jeśli występują w izolowanej formie (np. w związkach metaloorganicznych) są w zasadzie typowymi wiązaniami kowalencyjnymi, wyróżniają się jednak w stosunku do analogicznych wiązań między niemetalami dwiema istotnymi cechami:
Cechy te powodują, że w kryształach metali powstają pasma zdelokalizowanych elektronów, które mogą swobodnie się przemieszczać pod wpływem przyłożonego napięcia elektrycznego, dzięki czemu metale są dobrymi przewodnikami elektrycznymi. Ubocznym skutkiem tej delokalizacji jest też istnienie w metalach trójwymiarowej sieci silnych wiązań, co warunkuje dużą wytrzymałość mechaniczną metali, wysokie temperatury topnienia, kowalność, duży współczynnik rozszerzalności cieplnej i inne cechy charakterystyczne dla metali.
16. SCHARAKTERYZUJ WIĄZANIE WODOROWE
Wiązanie wodorowe - rodzaj stosunkowo słabego wiązania chemicznego polegającego głównie na przyciąganiu elektrostatycznym między atomem wodoru i atomem elektroujemnym zawierającym wolne pary elektronowe.
Klasyczne wiązanie wodorowe powstaje, gdy atom wodoru jest połączony wiązaniem kowalencyjnym z innym atomem o dużej elektroujemności (np. tlenem) i w ten sposób uzyskuje nadmiar ładunku dodatniego. W wyniku tego oddziaływania pierwotne, kowalencyjne wiązanie wodór - inny atom ulega częściowemu osłabieniu, powstaje zaś nowe, stosunkowo słabe wiązanie między wodorem i innym atomem (akceptorem wiązania wodorowego). Nie można wytłumaczyć natury tego wiązania wyłącznie za pomocą elektrostatyki, ponieważ oprócz przyciągania elektrostatycznego, zachodzi przeniesienie ładunku z akceptora na atom wodoru i związane z nim atomy, a także polaryzacja chmury elektronowej zarówno akceptora, jak i donora wiązania wodorowego.
17, 18. GAZ RZECZYWISTY RÓWNANIE IZOMERIA ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE
Stan gazu rzeczywistego opisuje równanie Van der Waalsa (p+![]()
)*V0 = RT
Gaz rzeczywisty ma podobne właściwości do gazu doskonałego jedynie, gdy jest rozrzedzony W gazie rzeczywistym odległości miedzy cząsteczkami są dość duze w miarę jak maleje objętość i wzrasta ciśnienie poruszające się cząsteczki mają do przebycia coraz krótsze drogi a wraz ze zmniejszeniem odległości między cząsteczkami rosną siły oddziaływania między nimi. Ciśnienie gazu rzeczywistego jest mniejsze od ciśnienia gazu doskonałego gdyż siły przyciągania cząstek osłabiają zderzenia ze ściankami naczynia
Temperatura krytyczna jest to temperatura, powyżej której pod żądanym ciśnieniem nie można gazu przeprowadzić w stan cieczy
Ciśnienie krytyczne jest to ciśnienie, pod którym gaz skrapla się w temperaturze krytycznej. W gazie rzeczywistym występują siły oddziaływania elektrostatycznego wywołane momentem dipolowym.
19. NASZKICUJ I OMÓW MOŻLIWE UGRUPOWANIA WYSTĘPUJĄCE W WODZIE W STANIE CIEKŁYM
-Zespoły cząstek powiązane wiązaniami wodorowymi (asocjaty)
- jony OH- oraz H3O+ powstałe z autodysocjacji wody
20. MOMENT DIPOLOWY TRWAŁY CHWILOWY WYIDUKOWANY
Moment dipolowy jest to iloczyn wielkości ładunku biegunów cząsteczki i odległości między nimi ![]()
=q*l
Jest to wektor o zwrocie od bieguna ujemnego do dodatniego
Trwały moment dipolowy jest sumą momentów dipolowych wszystkich wiązań w cząsteczce. Dipole trwałe mogą przyciągać się wzajemnie przeciwnymi biegunami
Wyidukowany moment dipolowy powstaje, jeśli cząsteczka będąca dipolem trwałym jest blisko cząstki niebędącej dipolem wówczas moment dipolowy indukuje w niej w taki sposób, że jest korzystnie zorientowany w stosunku do tej cząstki i obie cząstki przyciągają się
Chwilowy moment dipolowy powstaje on w atomach gdyż każdy elektron tworzy w danej chwili z jądrem dipol. Ponieważ ruch elektronów jest szybki taki układ jest nietrwały. Jeżeli dwa takie układy znajdą się blisko siebie starają się tak ustawić ruch elektronów, aby przeważały orientacje bardziej korzystne energetycznie.
21. WYJAŚNIJ POJĘCIA ALOTROPIA POLIMORFIZM IZOMERIA ANIZOTROPIA
Izotropia to brak zależności właściwości fizycznych od kierunku ich pomiaru w materiale. Występuje w ciałach bezpostaciowych
Polimorfizm jest to zdolność tych samych substancji do tworzenia w różnych warunkach kryształów o odmiennej strukturze i różnym rozmieszczeniu cząstek w przestrzeni. Jeżeli polimorfizm dotyczy pierwiastków wówczas mówimy o alotropii. Przykładem odmian alotropowych związanych z różnymi strukturami krystalicznymi jest węgiel i grafit
Izomeria jest to występowanie dwóch lub większej liczby związków chemicznych o tym samym wzorze sumarycznym, lecz różnej budowie cząsteczki. Związki te maja różne właściwości fizyczne i chemiczne. Izomerami są głównie związki organiczne znane jest piec związków o wzorze C6H14 lub butanC4H10 izobutan
Izomeria optyczna jest to występowanie cząstek związków chemicznych w dwóch nieidentycznych postaciach będących swoimi lustrzanymi odbiciami. Występuje gdy cząstki związku są chóralne.
Anizotropia [gr.], cecha ośrodka (ciała), polegająca na zależności niektórych jego właściwości (mech., elektr., opt.) od kierunku, w którym tę właściwość się bada; występuje gł. w kryształach i dotyczy m.in. przewodnictwa elektr. i cieplnego, łupliwości, właściwości optycznych. A. optyczna uwidocznia się w zależności prędkości rozchodzenia się światła w ośr. od kierunku (→ dwójłomność ); anizotropia optyczna wymuszona powstaje w ośr. izotropowych (→ izotropia), np. cieczach, pod działaniem zewn. pól elektr. (→ Kerra zjawiska)
Alotropia to rodzaj polimorfizmu polegającym na tym, że te same substancje występują w różnych odmianach różniących się właściwościami chemicznymi, fizycznymi lub budową krystaliczną czy liczbą atomów w cząsteczce (np. tlen w postaci O2 , O3, O4 )
22.ZJAWISKO NAPIĘCIA POWIERZCHNIOWEGO
Cząsteczki znajdujące się w głębi cieczy podlegają ze wszystkich stron przyciąganiu wywieranemu przez otaczające cząstki. Natomiast te cząstki, które są na powierzchni są silniej przyciągane przez ciecz niż przez gaz w skutek tego cząstki z powierzchni są wciągane w głąb cieczy. W wyniku napięcia powierzchniowego ciecz stara się przybrać kulki, aby mieć jak najmniejszy stosunek powierzchni do objętości.
Flotacja - metoda rozdziału rozdrobnionych substancji stałych, w której kryterium rozdziału jest różnica w zwilżalności ciała stałego przez ciecz.
W praktyce przemysłowej ciałem stałym najczęściej jest jakaś kopalina, a cieczą woda. Rozdrobniony materiał wsypuje się do zbiornika flotacyjnego zasilanego od spodu strumieniem powietrza. Cząstki trudno zwilżalne otaczają się w większym stopniu pęcherzykami powietrza niż łatwo zwilżalne, dzięki czemu unoszą się na powierzchnię, skąd są transportowane dalej
24. PORÓWNAĆ BUDOWE KRYSZTAŁÓW MOLEKULARNYCH KOWALENCYJNYCH I METALICZNYCH
Kryształy dzielimy ze względu na rodzaje wiązań między elementami kryształu trwałość ich rośnie od molekularnych przez jonowe do kowalencyjnych
Kryształy molekularne zbudowane są z atomów lub cząstek niepołączonych wiązaniami
np.(kryształy gazów szlachetnych) między cząsteczkami występują słabe oddziaływania Van der Waalsa z tego powodu są nietrwałe miękkie i nie przewodzą prądu
Kryształy kowalencyjne zbudowane są z atomów związanych wiązaniami kowalencyjnymi są to kryształy najtwardsze np. diament mają one wysoką temperaturę topienia i mały współczynnik rozszczepialności cieplnej
Kryształy metaliczne są zbudowane z dodatnio naładowanych jonów, między, którymi poruszają się swobodnie elektrony zwane gazem elektronowym w skład, którego wchodzą elektrony walencyjne. Są to kryształy wytrzymałe dobrze przewodzą prąd
25. REGUŁA FAZ GIBSA
Jest warunkiem współistnienia różnych faz i wyraz się wzorem z = s - f +2
f - faza. Jednorodna część układu ograniczona od innych powierzchnia podziału, po której przekroczeniu skład chemiczny substancji zmienia się
s - składniki tworzące dany układ np. NaCl s = 2 bo jest . NaCl i woda
z - liczba swobody jest to liczba czynników zewnętrznych i wewnętrznych wpływających na stan układu (temperatura ciśnienie), które można zmienić w układzie bez zmiany liczby faz
26. WYKRES CIŚNIENIE TEMPERATURA OBSZARY DWUFAZOWE PUNKT POTRÓJNY
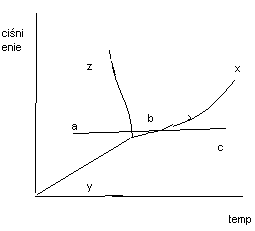
Wykres ten obrazuje zależność stanu skupienia wody od ciśnienia i temperatury
X - krzywa parowania prężność pary nasyconej nad cieczą
Y - krzywa sublimacji wpływ temperatury na prężność pary nasyconej nad cieczą
Z - krzywa krzepnięcia wpływ ciśnienia na temperaturę krzepnięcia
Punkt potrójny jest punktem równowagi trzech faz. Obszary dwufazowe są to obszary przejścia jednej fazy w drugą z jest to obszar sublimacji przejścia ciała stałego w gaz z pominięciem fazy ciekłej
27. SPOSÓB WYRAŻANIA STĘŻEŃ ROZTWORÓW
W roztworach dwuskładnikowych stężenie roztworu określa stosunek substancji rozpuszczonej do rozpuszczalnika. W roztworach wieloskładnikowych jest to stosunek jednego składnika do pozostałych
Stężenie wagowe jest to stosunek wagowy rozpuszczonej substancji do masy wszystkich składników
Ułamek molowy jest to stosunek liczby moli rozpatrywanej substancji do liczby moli wszystkich składników
Stężenie molowe jest to ilość moli rozpuszczonej substancji w 1 dm3 roztworu c=
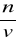
28. NARYSUJ DIAGRAM I OMÓW PROCES DESTYLACJI MIESZANINY DWÓCH ROZPUSZCZALNYCH W SOBIE CIECZY
Destylacja polega na wykorzystaniu różnicy w temperaturach wrzenia dwóch substancji w celu oddzielenia jednej od drugiej. Substancja o temperaturze wrzenia mniejszej odparowuje z roztworu i skrapla się w innym naczyniu.
29. PORÓWNANIE WYKRESU FAZOWEGO CZYSTEJ WODY I ROZTWORU WODNEGO
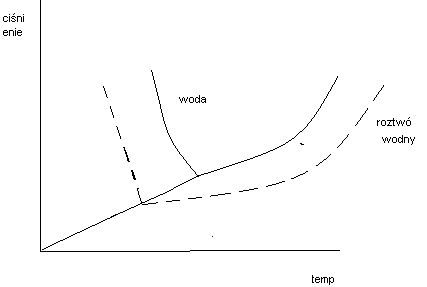
Obniżenie prężności pary nad roztworem powoduje, że jego wrzenie nastąpi w temperaturze wyższej niż wrzenie czystego rozpuszczalnika podwyższenie temperatury będzie zależało od rodzaju rozpuszczalnika i jego stężenia nie zależy zaś od rodzaju rozpuszczonej substancji. Roztwory wodne mają obniżona temperaturę krzepnięcia
30. PROCESY DESTYLACJI ZWYKŁEJ I FRAKCYJNEJ
Destylacja frakcyjna polega na rozdziale substancji mających różne temperatury wrzenia. Przeprowadza się ją w kolumnach destylacyjnych pod ciśnieniem atmosferycznym. Ogrzewa się substancje do wrzenia a odparowane składniki lotne skraplają się na poszczególnych półkach kolumny, które odpowiadają określonym temperaturom wrzenia danych substancji. Np. ropa naftowa
Destylacja zwykła również wykorzystuje różne temperatury wrzenia zmieszanych substancji i pozwala po kolei je rozdzielić.
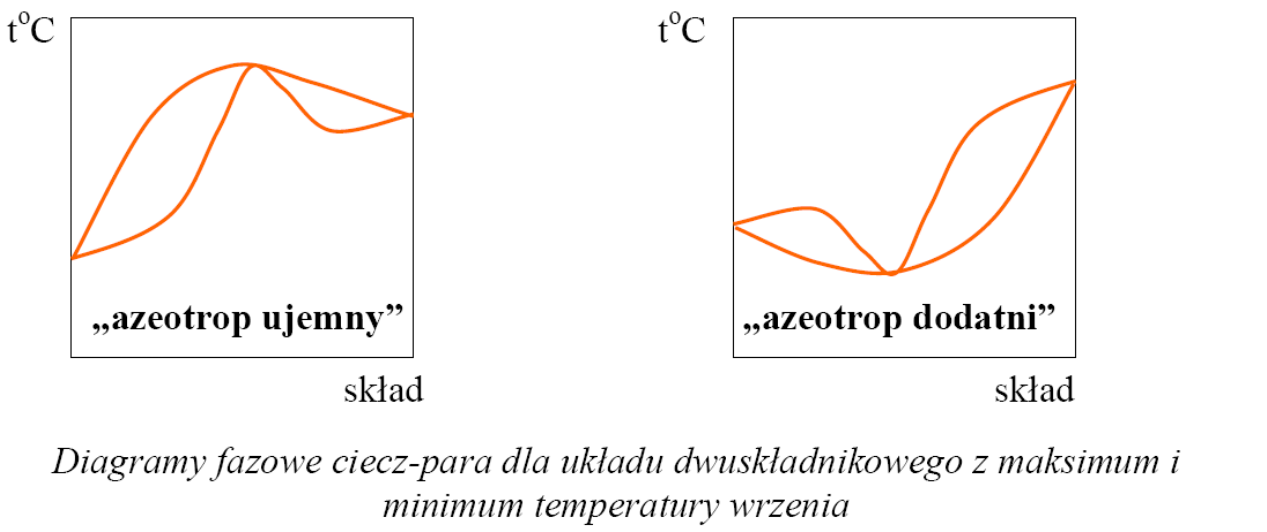
31. CO TO SĄ AZEOTROPY? NASZKICUJ I OMÓW AZEOTROP DODATNI I UJEMNY
Mieszanina azeotropowa (azeotrop) - ciekła mieszanina (roztwór) dwóch lub więcej związków chemicznych, która jest w równowadze termodynamicznej z parą nasyconą powstającą z tej mieszaniny. Gdy mówimy o azeotropie w kontekście wykresu fazowego, parametry takie określamy nazwą punktu azeotropowego.

32.PODZIAŁ UKŁADÓW KOLOIDALNYCH WŁAŚCIWOŚCI KOLOIDÓW HYDROFILOWYCH I HYDROFOBOWYCH
Koloidy są to mieszaniny zawierające fazę rozproszoną i fazę rozpraszającą. Jeżeli cząsteczki fazy rozproszonej łączą się z cząstkami ośrodka dyspersyjnego to jest to koloid liofilowy ( białka żelatyna)
Koloid liofobowy nie łączy się z cząstkami ośrodka dyspersyjnego czynnikiem stabilizującym te koloidy jest ładunek elektryczny. Jeżeli ośrodkiem dyspersyjnym jest woda to koloidy dzielimy na hydrofilowe i hydrofobowe
Faza rozpraszająca |
Faza rozproszona |
||
|
Gaz |
Ciecz |
Ciało stałe |
Gaz |
Mieszaniny jednorod |
Mgła |
Dym |
Ciecz |
Piana |
Emulsje |
Zol lub żel |
Ciało stałe |
Stała piana |
zawiesiny |
Stały zol |
. HYDROFOBOWOŚĆ FLOTACYJNA.
Istotę zjawiska widać na przykładzie.
Przez rozdrobniona w wodzie rudę metalu przepuszczamy powietrze. Polega to na tym, że hydrofobowe ziarna minerału przyczepiają się do hydrofobowych pęcherzyków powietrza i są wynoszone na powierzchnię gdzie gromadzą się w pianie. Natomiast hydrofilowe ziarna skały płonnej nie przybierają do pęcherzyków powietrza. Flotacja nie zachodzi, gdy ziarno jest hydrofilowe. Flotacja zależy od
Prawdopodobieństwa zderzenia ziarna z pęcherzykiem
Prawdopodobieństwa przytwierdzenia pęcherzyka do ziarna
Prawdopodobieństwa utworzenia trwałego wiązania gazu z cząsteczką
33. OPISZ BUDOWĘ ELEKTRYCZNEJ WARSTWY PODWÓJNEJ
Podwójna warstwa elektryczna
Podwójna warstwa elektryczna składa się z dwóch części (rys.10.5), warstwy adsorbcyjnej i dyfuzyjnej. Istnienie dwóch warstw jest powodem, że cząstka taką możemy przedstawić jako kondensator, którego jedną okładką jest powierzchnia cząstki, a druga okładka rozciąga się na pewną odległość w gląb cieczy.
W zjawiskach elektrokinetycznych ważną rolę odgrywa wartość potencjału na granicy pomiędzy warstwą adsorpcyjną a dyfuzyjną względem głębi roztworu.
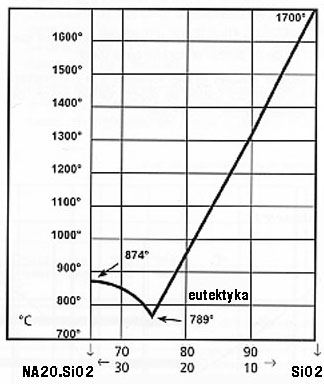
34. NARYSUJ DIAGRAM FAZOWY TEMPERATURA- SKŁAD DLA UKŁADÓW DWUSKŁADNIKOWYCH Z PUNKTEM EUTEKTYCZNYM
35. NARYSUJ SCHEMATYCZNY ZWIĄZEK O NAZWIE 2,2,4,5 -TETRAMETYLO- 4,5 DIETYLO HEPTAN
CH3 CH2CH3 CH2CH3
| | |
CH3 - C - CH2 - C - C - CH2 - CH3
| | |
CH3 CH3 CH3
36. NARYSUJ I OMÓW WYKRESY FAZOWY ŻELAZO-WĘGIEL
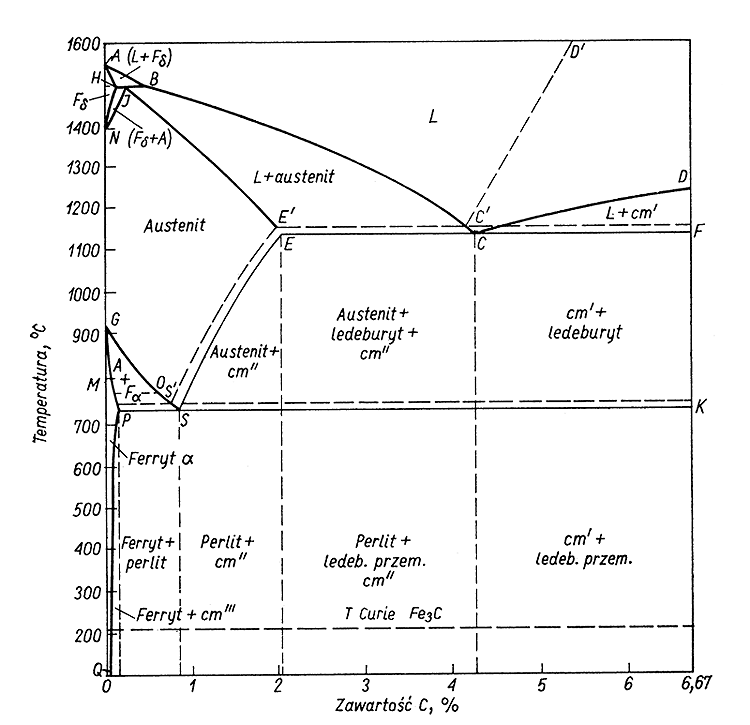
6,67% węgla > powstaje cementyt Fe3C
4,43% węgla > powstaje ledeburyt
0,8% węgla > powstaje perlit
37. DZIESIĘĆ NAJPROSTSZYCH ALKANÓW
Alkany to węglowodory nasycone i połączenia między atomami węgla są wiązaniami pojedynczymi wzór ogólny
CnH2n+2 metan etan propan butan pentan heksan heptan oktan nonan dekan
Alkeny są to węglowodory nienasycone z jednym wiązaniem podwójnym. Mają końcówkę en w nazewnictwie wzór ogólny CnH2
Alkiny są to węglowodory posiadające jedno wiązanie potrójne w nazewnictwie mają końcówkę yn
Wzór ogólny CnH2n+2
38. NASZKICUJ BUDOWĘ CHEMICZNĄ (ORBITALNA) METANU I ETYLENU
39. CO TO JEST IZOMERIA. OMÓW JĄ NA PRZYKŁADACH.
Izomeria to zjawisko istnienia różnic w budowie lub właściwościach cząsteczek o takim samym składzie atomowym
40. OMÓWIĆ IZOMERIE CIS—TRANS
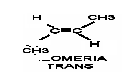
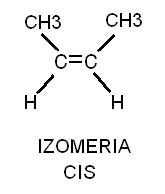
Izomeria ta dotyczy alkenów. W izomerii cis obie cząsteczki grupy metylowej leżą po tej samej stronie płaszczyzny prostopadłej do płaszczyzny wiązania podwójnego i niem. Natomiast w izomerii trans cząstki grupy metylowej leżą po przeciwnych stronach płaszczyzny prostopadłej do płaszczyzny wiązania podwójnego
42. ZWIĄZKI AROMATYCZNE
Aromatyczne związki, cykliczne związki org. o pierścieniach płaskich, zawierających sprzężony układ wiązań podwójnych, w których liczba elektronów wynosi 4n+2 (n =1, 2, 3...). Do związków aromatycznych należą węglowodory (areny) i ich pochodne; odznaczają się trwałością chem.; Nie mają typowych właściwości związków nienasyconych; ulegają reakcjom podstawienia elektrofilowego (np. nitrowaniu, sulfonowaniu, fluorowcowaniu, reakcji Friedela i Craftsa). Związki aromatyczne mogą być jednopierścieniowe (np. benzen i jego pochodne) lub ich cząsteczki mogą zawierać kilka pierścieni połączonych łańcuchowo (np. bifenyl i jego pochodne) lub skondensowanych (np. naftalen, antracen). W miarę zwiększania się w cząsteczce liczby skondensowanych pierścieni słabnie charakter aromatyczny związku zawierają wiązania zdelokalizowane
Benzen, C6H6, związek org., najprostszy, podstawowy węglowodór aromatyczny (→ aromatyczne związki); bezb. Ciecz o charakterystycznej woni; temp. wrz. 80°C; pali się kopcącym płomieniem; nie miesza się z wodą, dobrze miesza się z wieloma substancjami org.; toksyczny, rakotwórczy, wykazuje działanie narkotyczne
43. CO TO SĄ KWASY KARBOKSYLOWE
Cząsteczki kwasów karboksylowych są zbudowane z grupy alkinowej lub arylowej związanej z grupą karboksylowa -COOH . Nazwy systematyczne tworzymy przez dodanie do węglowodoru końcówki -owy. Kwasy te są cieczami o ostrym zapachu ich zapach słabnie wraz ze wzrostem długości łańcucha a rośnie temp. Wrzenia i topnienia i stają się woskowatymi cieczami np. kwas mrówkowy HCOOH octowy CH3COOH
44. CO TO SĄ AMINY
Aminy są to pochodne aminokwasów, w których jeden z atomów wodoru został zastąpiony grupa alkilową lub arylową. Wyróżniamy aminy pierwszorzędowe dwu- i trzyrzędowe w których to 1, 2 lub 3 atomy zostały zastąpione I R1NH2 II R2NH III R3N . Nazwy tworzymy dodając do nazwy związku przedrostek amino-
Temp. Wrzenia aminów są niskie gdyż wiązania wodorowe pomiędzy cząsteczkami są słabe. Tworzą zaś silne wiązania wodorowe z cząsteczkami wody, co powoduje, że się dobrze rozpuszczają.
45. CO TO SĄ KETONY A CO ALDEHYDY
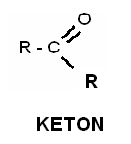
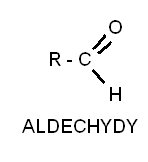
Aldehydy są to związki o wzorze ogólnym charakteryzują się występowaniem grupy CHO Ketony zaś posiadają grupę karbonylową a C=O o wzorze ogólnym. Obecność grupy karbonylowej powoduje że oba związki są bardziej polarne i maja wyższe temp. Wrzenia niż związki niepolarne. Ogólnie związki te są cieczami oprócz aldehydu mrówkowego.
46. CO TO SĄ ETERY A CO ZWIĄZKI CYKLICZNE
Są to związki o cząsteczkach, w których dwa rodniki węglowodorowe są połączone ze sobą atomem tlenu mogą mieć budowę łańcuchową R-OR' lub pierścieniową.
Etery cykliczne, których przynajmniej jeden z atomów węgla będący w pierścieniu jest zastąpiony atomem innego pierwiastka. Etery są dobrymi rozpuszczalnikami ze względu na swoją polarność i zdolność do tworzenia wiązań wodorowych
Etery otrzymujemy przez dehydrotacja alkoholu etylowego
Związki cykliczne to głównie związki organiczne, w których atomy wiążą się ze sobą tworząc pierścieniowe struktury. Gdy pierścień składa się z atomów jednego rodzaju jest to związek homocykliczny, a gdy z wielu rodzajów atomów to jest to związek heterocykliczny.
47. DYSOCJACJA ELEKTROLITYCZNA. STAŁA DYSOCJACJI PRZYKŁADY ELEKTROLIZY
Dysocjacja elektrolityczna jest to rozpad kryształów jonowych lub cząsteczek polarnych na jony pod wpływem wody. Suma ładunków jonowych powstałych w dysocjacji jest równa zero.
Elektrolity są to substancje, które w roztworach wodnych przewodzą prąd są to sole, wodorotlenki, kwasy.
- kwasy dysocjują na kationy wodorowe i na aniony reszty kwasowej H+ R-
-zasady dysocjują na kationy metalu i aniony wodorotlenkowe M+ OH-
-sole dysocjują na kationy metalu i aniony reszty kwasowej M+ R-
Stopień dysocjacji określa stopień cząstek dysocjowanych do całkowitego stężenia elektrolitu. Elektrolity mocne HCC NaOH H2 SO4 całkowicie dysocjowane elektrolity słabe H2CO3 CH3COOH w tych cząstkach wiązania między wodorem a resztą cząsteczki są spolaryzowane
Stała dysocjacji określa moc danego elektrolitu
48, 49. DYSOCJACJA WODY, SKŁAD pH, INDYKATORY pH
Woda jest słabym elektrolitem źle przewodzi prąd elektryczny, ponieważ tylko niektóre cząstki są dysocjowane
Jon wodorowy, który powstał w wyniku dysocjacji nie znajduje się w stanie wolnym, lecz w postaci uwodnionej łączy się on z cząstka wody. Łączenie to jest wywołane biegunowością cząsteczki. (Dodatni atom wodoru H+ przyłącza się do dodatniego atomu tlenu)
Iloczyn jonowy wody wzrasta wraz z temp.
PH- stężenie jonów wodorowych w roztworze
Ze wzrostem stężenia jonów wodorowych maleje stężenie jonów OH+ i odwrotnie
Roztwór obojętny H+=OH- roztwór kwaśny H+ >OH- pH<7 roztwór zasadowy H+<OH- pH>7
Indykatory pH- są to słabe kwasy lub zasady organiczne, które pod wpływem stężenia jonów zmieniają swoją barwę
-błękit metylowy
-czerwień metylowa
-oranż metylowy
-lekmus
fenoloftaleina
50. ILOCZYN ROZPUSZCZALNOŚCI
Rozpuszczalności iloczyn, L, iloczyn aktywności produktów dysocjacji (jonów) substancji rozpuszczonej w roztworze nasyconym tej substancji inaczej jest to iloczyn stężenia jonów trudnorozpuszczalnego elektrolitu; dla substancji AnBm dysocjującejwg równania: A nBm = nA m+ + mBn- i.r. wyraża się wzorem L = · (aA — aktywność jonów A m+, aB — aktywność jonów Bn-, n i m — współczynniki stechiometryczne); dla substancji trudno rozp. można przyjąć, że iloczyn rozpuszczalności jest iloczynem stężeń (c) jonów i wówczas L = ; dla danej substancji i danego rozpuszczalnika wartość iloczynu rozpuszcalności w określonej temperaturze jest stała; gdy iloczyn stężeń jonów danej substancji przekroczy wartość iloczynu rozpuszczalności, następuje wydzielenie się osadu tej substancji.
51. POLIELEKTROLITY
Są to związki wielocząstkowe zwierające w swojej strukturze składniki jonowe są one rozpuszczalne w wodzie i w roztworze dysocjują na jony. Właściwości fiz i chem polielektrolitów różnią się od elektrolitów zwykłych wynika to z oddziaływań elektrostatycznych odpychanie pomiędzy jednoimiennie naładowanymi grupami i przyciągania niskocząsteczkowych jonów o przeciwnym znaku do jonu wielkocząsteczkowego odpychanie wzrasta z rozcieńczeniem roztworu. W przeciwieństwie do elektrolitów zwykłych słabe polielektrolity wykazują zależność stałej dysocjacji od stopnia dysocjacji
52.KOROZJA ŻELAZA
Niszczenie materiałów na skutek oddziaływania środowiska
Korozja chemiczna następuje w wyniku reakcji metalu z aktywnymi gazami np. tlenem,chlorowodorem,tlenkami azotu
korozja elektrochemiczna jest wynikiem działania mikro ogniw galwanicznych w środowisku wodnym żelazo będzie ulegało utlenianiu i w postaci jonów przejdzie do roztworu Fe=Fe2++2e- proces ten zachodzi w środowisku kwaśnym
Proces korozji w środowisku obojętnym można zapisać Fe= Fe2+ + 2e-
Końcowym produktem korozji jest rdza nalot o barwie brunatnej o wzorze 2Fe2O3*3H2O nie jest ona związana z metalami i umożliwia dalszy postęp korozji korozja w wodzie słonej przebiega szybciej niż w słodkiej jest ona mocniejszym elektrolitem
54.PRAWO ZACHOWANIA MASY
Podczas reakcji chemicznej suma mas substratów równa się sumie mas produktów
55.CO TO JSET UTLENIANIE I REDUKCJA
utlenianie zmiana liczby elektronów w otoczeniu jądra reagującego atomu jeżeli jest to utrata elektronów czyli wzrost ładunku dodatniego jest to utlenianie A![]()
An++ne- Fe![]()
Fe2+ +2e-
redukcja jest to zmniejszenie ładunku dodatniego czyli pobranie elektronów B+ne-![]()
Bn- Cu2+ +2e-![]()
Cu Obie reakcje są reakcjami typy redoks
Reduktor atom, który podczas utleniania oddaje atom
Utleniacz atom, który pobiera elektrony redukuje swój stopień utlenienia
Stopień utlenienia odpowiada wartości pierwiastka, jeżeli atom oddał elektron to jest on dodatni, jeżeli przyjął to ujemny
Suma stopni utlenienia w cząsteczce jest równa 0
56.CO TO JEST ENERGIA WEWNĘTRZNA PIERWSZA ZASADA TERMODYNAMIKI
Energia wewnętrzna układu jest sumą energii poszczególnych cząstek wchodzących w skład układu. Zgodnie z pierwsza zasadą termodynamiki zmiana energii wewnętrzna może nastąpić na sposób ciepła Q albo na sposób pracy w![]()
U=Q+W Q- ciepło dostarczane do układu w pracach wykonywanych przez układ. Zmiana energii układu przy stałej objętości równa się ciepłu przemian. Ogólnie zmiana energii wew. Zależy od drogi, po której układ przeszedł ze strony A do B
57.CO TO JEST ENTALPIA
jest to funkcja stanu, która zależy od parametrów stanu, ciśnienia objętości temp. Cechą jej jest niezależność jej zmian od drogi przemian stosuje się ja przy oposie energetycznych reakcji
![]()
H=![]()
U+ p*![]()
V p- ciśnienie ![]()
H zmiana entalpii jest równa
Entalpia jest energia wymienialna na sposób ciepła w warunkach izobarycznych, jeżeli entalpia jest <0 to jest to reakcja egzotermiczna jeżeli![]()
H>0 to jest to reakcja endotermiczna
58. ENTROPIA
Jest miara stopnie nieuporządkowania i rozmieszczenia cząstek tworzących układ. Jeżeli układ ulega przemianie to zmienia się także jego entropia.
Ciała stałe w temp. Zera absolutnego maja entropie równa 0 w miarę wzrostu temp entropia wzrasta
Entropia wyraża liczbę sposobów podziału energii wewnętrznej na poszczególne cząstki
Wpływ entropii na entalpie zależy od temp., W której następuje przemiana. Entropia jest funkcja stanu zdefiniowaną przez równanie Stefana Boltzmana S=k *lnW; W- liczba swobód podziału energii
59. REAKCJE EGZO I ENDOTERMICZNE
Egzotermiczna są to takie proces, który prowadzony w warunkach izotermicznych i izobarycznych powoduje przepływ energii z układu do otoczenia
Reakcja endotermiczna powoduje przepływ energii z otoczenia do układu
62. OMÓW ZASADE REGUŁY PRZEKORY LE CHATELIER-BRAUNA
Jeśli układ znajdujący się w równowadze dynamicznej zostanie poddany jakiemuś działaniu zew. Tzn. zmieni się któryś z parametrów warunkujących jego równowagę, to układ dążył do zmniejszenia stosunków tego działania.
Działanie reguły przekory ilustrują przykłady:
1. Dodanie do nasyconego roztworu siarczanu ołowiu(II) dodatkowych ilości jonów siarczanowych, a więc zwiększenie ich stężenia, spowoduje zmętnienie roztworu
Pb2++SO42-=PbSO4
2 Zgodnie z zasada Le Chateliera i Brana zwiększenie ciśnienia gazowej mieszaniny pary wodnej, wodoru i tlenu znajdującej się w stanie równowagi spowoduje taką zmianę równowagi, by ten wzrost częściowo zniwelować.
Z każdych dwu cząsteczek wodoru i jednej cząsteczki tlenu powstają dwie cząsteczki wody-ciśnienie zmniejsza się
3. Podwyższenie temp. Mieszaniny H2O+CO2+CO+H2 znajdującej się w stanie równowagi powoduje odpowiednie zwiększenie stężeń tlenku węgla i pary wodnej
Wzrost temp. Powoduje zwiększenie wydajności reakcji endotermicznej:
CO2 +H2=CO+ H2O ![]()
rH=40,3 kJ*m-3
Gdy ta reakcja przebiega, to układ pochłania ciepło i temp. obniża się
64. WYMIEN 10 DOWOLNYCH MINERAŁOW. PODAJ ICH WZORY CHEMICZNE
---------------------------------------------------------------------------------
65. OMOW MECHANIZMY WIETRZENIA CHEMICZNEGO MINERAŁÓW
DIAGENEZA
Pierwotnie stracony w morskim osadzie węglan wapnia w skutek długotrwałego oddziaływania zawartych w wodzie morskiej jonów magnezu ulega reakcji
2CaCO2+Mg2+![]()
CaMg(Ca3)2+Ca2+
Zjawisko to często prowadzi do całkowitej dolomityzacji osadu. Oddziaływanie jonów żelaza zawartych w wodzie morskiej na świeżo stracony siarczek miedzi może dojść do powstania siarczku mieszanego (chatkopirytu)
2CuS+Fe2+![]()
CuFeS2+ + Cu2+
Stracone siarczki cynku, ołowiu i miedzi w zasadzie mogą ulec wyłącznie w siarczek miedzi , którego jony z wyższych warstw roztworem oddziaływają na osad.
METAMORFOZA
Najważniejsza role odgrywają temp. i ciśnienie. W tych warunkach skały węglanowe reagują z krzemionka i zachodzi reakcja
CaMg(CO3)2 + 2SiO2 ![]()
CaMgSi2O6 +2CO2
Dolomit kwas diopsyd
Ciśnienie wynika z ciężaru nadkładu
66. PODAJ PRZYKŁADY ROZPUSZCZANIA HYDRACJI, HYDROLIZY, KARBONATYZACJI,UTLENIANIA W PROCESACH TWORZENIA ZŁÓŻ OSADOWYCH
ROZPUSZCZANIE
Proces rozpuszczania ciał stałych zależy od budowy substancji rozpuszczanej i rozpuszczalnika. Podczas rozpuszczania musza zostać pokonane siły przyciągania między elementami sieci krystalicznej oraz siły spójności działającej między cząsteczkami rozpuszczalnika
Obydwa te procesy wymagaj nakładu energii, która może być pobierana z otoczenia.
W wodzie, która jest rozpuszczalnikiem polarnym i ma durzą stałą dielektryczna dobrze rozpuszczają się związki zbudowane z jonów np. NaCl
Rozpuszczanie jest procesem odwracalnym, a więc przez usuniecie rozpuszczalnika np. przez odparowanie można odzyskać substancje rozpuszczoną.
Rozpuszczalność substancji stałych wzrasta wraz z temperaturą rośnie dla różnych substancji
Iloczyn rozpuszczalności:
CaCO3=Ca2+ + CO32-
HYDRATACJA
Jest procesem zmiany minerałów bezwodnych w uwodnione. Proces ten może powodować przeobrażenia masy mineralnej, ale nie prowadzi do jej destrukcji. Najlepszym przykładem jest uwadnianie się anhydrytu do gipsu:
CaSO4 (anhydryt) + 2H2O ![]()
CaSO4 * 2H2O (gips)
HYDROLIZA
Proces ten prowadzi do rozkładu głównych składników skal pierwotnych tzn. glinokrzemianów na krzemionkę i wodorotlenek glinu
Klimacie umiarkowanym przebiega on tylko częściowo
np. 6 KALSi2O4 + 4H2O ![]()
2KAL2Si2O10(OH)2 + 12 SiO2 + 4K+ + 4OH-
Skaleń potasowy illit
W klimacie tropikalnym hydroliza skalenia może przebiegać całkowicie prowadząc do powstania hydrogilitu
4KALSi3O8 + 8H2O![]()
4Al(OH)3 + 12SiO2 + 4K+ + 4OH-
Skaleń potasowy hydroglit
KARBONATYZACJA
Jest procesem wypierania z masy mineralnej anionów krzemionkowych przez CO2 lub aniony węglanowe CO32 i HCO3-
Proces ten prowadzi np. do dolomityzacji pierwotnych skal krzemionkowych
Ca(Mg,Fe)[Si2O6] + 2H2O + 2CO2 ![]()
Ca(Mg, Fe)CO3 + 2H2SiO3
Jak widać z tej reakcji procesowi karbonatyzacji towarzyszy często proces hydrolizy.
Innym przykładem współdziałania wody i CO2 w procesie wietrzenia jest przeobrażanie się siarczków miedzi i zasadowy węglan miedzi melachit Cu[(CO3)(OH)2]
Procesowi karbonatyzacji może ulegać np. serpentyn tworząc talk imagneryt Złoża tego typu występują na Dolnym Śląsku
UTLENIANIE
Ma zasadnicze znaczenie dla procesów wietrzenia. Prowadzi szerokim zakresie do przeobrażania związków trudno rozpuszczalnych w łatwo rozpuszczalne np. siarczki w siarczany (jony niżej utlenione w jony wyżej utlenione).Utlenianie w połączeniu z procesem rozpuszczania powoduje silna destrukcje i niszczenie skal pierwotnych.
Utlenianiu łatwo ulęgają siarczki
Np. PbS + 2O2 ![]()
PbSO4
Galena antygleryt
Fe2SiO4 + 0.5 O2 + 2H2O ![]()
FeO3 + H4SiO4
Fajalit hematyt kwas krzemowy
Czerwone, brunatne i czerwone barwy utlenionych złóż żelaza wynika z obecności w nich związków, w których żelazo występuje w różnych stopniach uwodnienia i utlenienia
Oprócz żelaza utlenieniu mogą ulegać jony
S2- ![]()
S6+ Mn2+![]()
Mn4+ Cr3+![]()
Cr6+
67. OMÓW ZŁOŻA:
Rezydualne złoża, złoża kopalin, stanowiące klasę złóż wietrzeniowych. Powstają w wyniku procesu wietrzenia chemicznego, przez nagromadzenie się w miejscu trwania tego procesu przekształconego chemicznie materiału skalnego, stanowiącego wcześniej składnik skały ulegającej wietrzeniu (pozostałe składniki zostały odprowadzone z miejsca wietrzenia).
68. WYMIEN 5 TWORZYW SZTYCZNYCH. PODAJ ICH NAZWE HANDLOWĄ I CHEMICZNĄ OMOW ICH WŁAŚCIWOŚCI
POLIETYLEN CH2=CH2
Zastosowanie (folia, opakowania, rury, izolacja elektryczna.)
Jest tworzywem termoplastycznym, zbudowanym z giętkich łańcuchów. Bywa zaliczany do elastomerów. Pod dużym obciążeniem ulega trwałym odkształceniom. Jest bardzo dobrym izolatorem, stosowany do wyroby izolacji kabli i drobnych części konstrukcyjnych w radiotechnice
POLISTYREN CH2 = CH - C6H5
Zastosowanie {opakowania, izolacja elektryczna, izolacja cieplna (styropian))
Jest tworzywem stylonowym. Oprócz bardzo dobrych właściwości izolacyjnych wyróżnia się on dużą stabilnością parametrów elektrycznych.
Spieniony polistyren, znany pod nazwa styropianu, jest znanym materiałem izolacyjnym i na opakowania.
POLICHLOREK WINYLU CH2=CHCl
Zastosowanie(aparatura chemiczna, folia, opakowania, rury, izolacja, okładziny, płyty ).
Jest polimerem termoplastycznym. Otrzymywany różnymi metodami, ma różne właściwości fizyczne min podatność na przetwarzanie.
Ma małą odporność cieplna i już nieco powyżej 1000C zaczyna się rozkładać z wydzieleniem chlorowodoru.
Największe ilości PCW są zużywane w budownictwie, budownictwie, którym zastępuje drewno i materiały instalacyjne (w postaci rur wodnych i kanalizacyjnych),
FENOPLASTY C6H5OH
Są to tworzywa termoutwardzalne, wytwarzane w reakcji polikondensacji fenolu z formaldehydem.
Stosowane jako spoiwo do laminatów, w przemyśle motoryzacyjnym i elektrochemicznym, są obecnie wycofywane ze względów ekologicznych.
69. POROWNAJ REAKCJE POLIMERYZACJI POLIADDYCJI I POLIKONDENSACJI
POLIMERYZACJA
Jest to proces łączenia się ze sobą cząstek reaktywnego związku chemicznego, zwanego monomerem z utworzeniem cząsteczki polimeru, bez wydzielania się produktów ubocznych
Najczęściej stosowanymi monomerami są związki organiczne zawierające w swojej cząsteczce wiązania podwójne
Reakcja polimeryzacji
nR-CH= CH2- ![]()
-[-CHR-CH2-]-n
Powstający polimer ma budowę łańcuchową
Polimeryzacje monomeru można prowadzić w masie(metodo blokowa) w zawiesinie wodnej (metoda suspensyjna) w emulsji lub roztworze
POLIKONDENSACJA jest to proces syntezy polimeru polegający na reakcji cząsteczek związków chemicznych ze sobą, przy czym wydzielają się małocząsteczkowe produkty uboczne jak np. woda
W przeciwieństwie do polimeryzacji polikondensacja jest to rekcja stopniowo przebiegająca wolniej a często prowadząca do ustalenia stanu równowagi
Ta metoda znalazła duże zastosowanie do syntezy poliestrów, poliamidów, aminoplastów, silikonów
POLIADDYCJA
Polimery addycyjne powstają w wyniku reakcji addycji (dodawania) cząstek monomeru, który ma wiązania wielokrotne np. polimeryzacja etanu
[ H H ] [ H H ]
[ ![]()
![]()
] [ ![]()
![]()
]
n[ C=C ] ![]()
[-C- C- ]
[![]()
![]()
] [ ![]()
![]()
]
[ H H ] [ H H ] n
Prostymi przykładami poliaddycji są reakcje syntezy polietylenu, polichlorku winylu i polistyrenu.
W syntezie polietylenu monomerem jest cząsteczka etanu C2H4
a merami -grupa CH2
70. OGÓLNIE SCHARAKTERYZUJ POLIMERY. CO TO JEST STOPIEN POLIMERYZACJI, CIĘŻAR CZASTESZKOWY? JAK WPŁYWAJĄ TE PARAMETRY NA ICH WŁAŚCIWOŚCI I STAN FIZYCZNY?
POLIMERY są to związki wielocząstkowe, zawierające w swoje budowie powtarzające się elementy składowe, zwane merami. W każdej cząsteczce polimeru znajduje się duża liczba połączonych ze sobą merów. W miarę zwiększania się liczby merów w cząsteczce polimeru zwiększa się jej masa cząsteczkowa oraz zmieniają niektóre właściwości fizyczne takie jak temp.
Znane są 3 metody syntezy polimerów
-polimeryzacja
-polikondensacja
-modyfikacja chemiczna polimerów naturalnych i syntetycznych
Miarą wielkości cząsteczek polimeru jest ich masa cząsteczkowa i związany z nią stopień polimeryzacji, który wskazuje z ilu powtarzających się segmentów strukturalnych (merów) składa się jedna cząsteczka
Średnia masa cząsteczkowa polimeru
Stopień polimeryzacji= -----------------------------------------------
Masa cząsteczkowa meru
Wiele właściwości fizycznych polimeru zależy od średniej masy cząsteczkowej i od rozkładu wielkości jego cząsteczek.
Niektóre właściwości polimerów udaje się osiągnąć przez polimeryzacje addycyjną dwu lub więcej rodzajów monomerów.
Powstałe kopolimery mogą mieć budowę:
-przemienną A-B-A-B-A-B-A-B-A-B
-bezładną A-B-B-B-A-B-A-A-A-B
-blokową A-A-B-B-A-A-B-B-A-A
72. SCHARAKTERYZUJ WYBUCH:
Wybuch - w mowie potocznej - gwałtowne wydzielenie w jednym miejscu dużych ilości energii. Wybuchowi towarzyszy zwykle nagły wzrost temperatury i wzrost ciśnienia. Wybuch powoduje powstanie fali uderzeniowej. W zależności od prędkości rozchodzenia się tej fali oraz mechanizmu wybuchu rozróżnia się deflagrację (zwaną inaczej wybuchem właściwym), eksplozję i detonację .
Większość materiałów wybuchowych działa na skutek gwałtownej, egzotermicznej reakcji chemicznej. Wzrost ciśnienia w otoczeniu wybuchu może wynikać z czterech przyczyn:
-powstaniu dużych ilości gazowych produktów reakcji chemicznej, która spowodowała wybuch -powstaniu dużych ilości gazów w reakcjach wtórnych -rozprężeniu się gazów, które wcześniej występowały w strefie wybuchu pod wpływem gwałtownego wzrostu temperatury -parowaniu i sublimacji cieczy i ciał stałych w strefie wybuchu.
73. PODAJ RODZAJE WYBUCHÓW
Wyróżnia się następujące rodzaje wybuchu: detonacja, wybuch zwykły i deflagrację. Detonacja polega na rozkładzie cząsteczek materiału wybuchowego z prędkością od 1000 do 8500 m/s, który prowadzi do krótkotrwałych, ale silnych ciśnień gazów, które rozprężając się kruszą otaczające środowisko. Materiały detonujące nazywamy kruszącymi. Detonacje poznaje się po obecności fali detonacyjnej (drgania powietrza i ziemi) i silnym huku. Wybuch zwykły polega na szybkim spalaniu się substancji palnej mieszaniny wybuchowej z udziałem tlenu zawartego w innym składniku materiału wybuchowego. Wybuch zwykły zachodzi z prędkością od 400 do 1000 m/s.
Podczas wybuchu zwykłego rozprężania gazów jest wolniejsze niż przy detonacji. Materiały które ulegają wybuchowi zwykłemu nazywa się motającymi. Wybuchowi zwykłemu towarzyszy huk. Deflagracja polega na nierównomiernym i raczej powolnym niejednorodnym zachodzeniu reakcji potencjalnie wybuchowej, która zachodzi z prędkością od kilku do kilkudziesięciu m/s. Deflagrację można porównać do bardzo szybkiego palenia się. Deflagracji może towarzyszyć gwizd lub syk. Deflagracji mogą ulegać zarówno materiały kruszące jak i motające.
74. PODAJ REAKCJE ZACHODZACE PODCZAS WYBUCHU NA PRZYKŁADZIE NITROGLICERYNY, PENTRYLU LUB TROTYLU
NITROGLICERYNA:
CH2-ONO2
|
CH -ONO2 = 6CO2 + 5H2O + NO + 5/2N2
|
CH2-ONO2
PENTRYT:
CH2ONO2
❘
O2NOCH2 - C-CH2ONO2 = 5CO + 4H2O + 2N2+ 1.5O2 = 3 CO2 +2CO +4H2O + 2N2
❘
CH2ONO2
TROTYL
= 14C + 5H2O + 3N2 + 3.5O2 = 7CO +7C + 5H2O + 3N2
76. CO TO JEST PROCH STRZELICZY, SALETRA STRZELNICZA I PROCH BEZDYMNY. CZY SĄ ONE MATERIAŁAMI WYBUCHOWYMI MIOTAJĄCYMI?
Materiały wybuchowe wolno działające (miotające)
Materiały miotające o prędkości reakcji około 600 m/s używa się głównie w górnictwie skalnym. Jako materiały miotające stosuje się prochy dymne, przede wszystkim PGS (proch górniczy skalny). Proch strzelniczy dymny czarny jest mieszaniną saletry potasowej (KNO3), węgla drzewnego oraz siarki i stosowany jest od kilku tysięcy lat. Proch dymny bardzo łatwo się zapala od płomienia
78. OMÓW MATERIAŁY KRUSZACE Z GRYPY ESTRÓW HNO3
Substancja |
Wzór |
właściwości |
nitrogliceryna (poprawnie triazotan gliceryny) |
|
bezbarwna, oleista, trująca, silnie wybuchowa ciecz. Tt =8oC. W stanie stałym przełamywana wybucha
|
nitroglikol (poprawnie diazotan glikolu etylenowy) |
|
bezbarwna, trująca, wybuchowa ciecz. Trudnozamarzalny materiał wybuchowy gdyż jego Tt = -22,3oC.
|
79. MATERIAŁY KRUSZĄCE Z GRUPY NITROZWIĄZKÓW AROMATYCZNYCH
W grupie nitrozwiązków aromatycznych grupa nitrowa -NO2 związana jest bezpośrednio z atomem węgla. Związki te są dobrymi środkami wybuchowymi i mają tę zaletę, że są mało czułe na bodźce mechaniczne.
80. MATERIAŁY KRUSZĄCE Z GRUPY NITROAMIN
Do grupy nitroamin zalicza się tetryl, heksogen i nitroguanidynę. W nitroaminach grupa nitrowa -NO2 związana jest z atomem azotu grupy aminowej tak, jak to pokazano w tabeli 3. Nitroaminy są silnymi materiałami wybuchowymi, są także trwałe chemicznie i trudne do zainicjowania, dlatego używane są jako materiały wybuchowe inicjujące wtórne.
81. MATERIAŁY WYBUCHOWE AMONOWO-SALETRZANE
Znana sól saletra amonowa NH4NO3 jest materiałem wybuchowym. Zmieszanie saletry amonowej w ilości 50% z żelatynowaną dwunitrochlorohydryny lub nitroglikolem pozwala na otrzymanie żelatynowanego materiału wybuchowego dobrze działającego w niskich temperaturach. Saletrę amonowa miesza się także z wieloma innymi substancjami otrzymując materiały wybuchowe, które mają zastosowanie zarówno w górnictwie odkrywkowym jak i w górnictwie podziemnym. W górnictwie stosuje się amonity, które są mieszaniną saletry amonowej i innych materiałów wybuchowych oraz substancji palnych i obojętnych. Mieszanie saletry amonowej z nitrogliceryną (4%) oraz pewnej ilości soli kuchennej, aby obniżyć temperaturę wybuchu, daje karbonity. Karbonity stosuje się w kopalniach węglowych niemetanowych.
83. WYMIEŃ I OMÓW MATERIAŁY WYBUCHOWE INICJUJĄCE PIERWOTNIE I WTÓRNIE
Dobre materiały wybuchowe muszą być bezpieczne podczas ich produkcji, transportu i magazynowaniu, a zatem muszą się charakteryzować dużą odpornością na wybuch pod wpływem prostych bodźców zewnętrznych takich jak tarcie, wstrząs czy temperatura. Detonacja bezpiecznych materiałów wybuchowych odbywa się tylko pod wpływem silnego bodźca jakim jest wybuch powodowany innym materiałem wybuchowym zwanym inicjującym. Czasami stosuje się więcej niż jeden materiał inicjujący. Gdy stosuje się dwa materiały inicjujące, pierwszy z nich nazywany się pierwotnym, a drugi, który przenosi wybuch od inicjującego do zasadniczego materiału wybuchowego nazywa się inicjującym wtórnym.
Do pierwotnych inicjujących materiałów wybuchowych należą porunian rtęci, azydek ołowiu oraz trójnitrorezorcynian ołowiu (TNRO). Piorunian rtęci o wzorze (C=N-O)2Hg jest białym proszkiem. Niestety powoduje on korozję niektórych metali, zwłaszcza aluminium. Piorunian rtęci najlepiej przechowywać pod woda, gdyż w kontakcie z wodą traci zdolności wybuchowe. Azydek ołowiu o wzorze Pb(N3)2 jest, podobnie jak piorunian rtęci białym proszkiem, ale w stanie wilgotnym nie traci właściwości wybuchowych. Wchodzi w rekcje z metalami szlachetniejszymi od ołowiu, np. z miedzią oraz jej stopem mosiądzem i wtedy staje się bardziej zdolny do wybuchu.
Do wtórnych materiałów wybuchowych inicjujących zalicza się tetryl, heksogen, pentryt, oktogen, tetrazen i acetylenek miedzi (I)
Wyszukiwarka
Podobne podstrony:
teterycz, W5- elektryczny
teterycz, W5- elektryczny
klajn, W5- elektryczny
7493, W5- elektryczny
cichosz, W5- elektryczny
2807, W5- elektryczny
barcz, W5- elektryczny
cichosz, W5- elektryczny
antal, W5- elektryczny
3323, W5- elektryczny
krzywaźnia, W5- elektryczny
zawilak, W5- elektryczny
2947, W5- elektryczny
krzywaźnia, W5- elektryczny
krzywaźnia, W5- elektryczny
antal, W5- elektryczny
zawilak, W5- elektryczny
więcej podobnych podstron