1 mol (atomu, cząsteczki, jonu, rodnika = drobiny) - taka liczba drobin, która jest równa liczbie Avogadry (NA = 6,023*1023)
Masa molowa (M) - masa 1 mola drobin danej substancji (MH2 = 2g/mol)
Równania stechiometryczne
Schemat reakcji chemicznej
H2SO4 + Fe ![]()
Fe2(SO4)3 + SO2
↑
utleniacz
Równanie chemiczne musi spełniać dwa kryteria:
- prawo zachowania masy (sumaryczna masa produktów = sumaryczna masa substratów)
- prawo zachowania ładunku elektrycznego (sumaryczny ładunek produktów = sumaryczny ładunek substratów)
Reagenty = substraty i produkty
Utlenianie - pozbawianie substancji elektronów
Redukcja - powiększenie puli elektronów
Utleniacz - substancja zabierająca elektrony; ulega redukcji
Reduktor - oddaje elektrony; ulega utlenianiu
![]()
S = 6+ (2*(1+) + 4*(2-) = 6-)
![]()
+ Fe Fe2(SO4)3 + ![]()
Równania połówkowe
![]()
+ 2e + 2H+ = ![]()
+ 2H2O / *3 (aby liczba elektronów z tego równania była
(2H+ dodane w celu (2H2O dodane w celu taka sama jak z równania poniżej)
zachowania prawa ładunku) zachowania prawa masy)
(-2) (0) ładunek sumaryczny
![]()
- 6e + ![]()
= ![]()
(0) (0)
bo każdy atom
traci 3e
3H2SO4 + 6e + 6H+ + 2Fe - 6e + 3S![]()
= 3SO2 + 6H2O + Fe2(SO4)3
3H2SO4 + 3H2SO4 + 2Fe = 3SO2 + Fe2(SO4)3 + 6H2O
6H2SO4 + 2Fe = 3SO2 + Fe2(SO4)3 + 6H2O
równania muszą być odczytywane w formie molowej, a nie cząsteczkowej! (tzn. 6 moli cząsteczek, 2 mole elektronów, jonów, itd.)
współczynniki stechiometryczne zwykłe
6 H2SO4 + 2 Fe = 3 SO2 + Fe2(SO4)3 + 6 H2O
6MH2SO4 + 2MFe = 1MFe2(SO4)3 + 3MSO2 + 6MH2O
98 g/mol 55,8 g/mol 64 g/mol 18 g/mol
1MFe2(SO4)3 + 3MSO2 + 6MH2O - 6MH2SO4 - 2MFe = 0
współczynniki stechiometryczne algebraiczne
((+) mają prodkuty, (-) mają sobstraty, bo zanikają)
symbol współczynników algebraicznych = υ
υSO2 = 3 υH2SO4 = 6
ΣiυiMi = 0
1) ΔnH2SO4 = -3 => ΔnFe = -1 ΔnFe2(SO4)3 = +0,5 ΔnSO2 = +1,5 ΔnH2O = +3
↑ ↑
zmiana liczby zanikowi 6 moli H2SO4
moli w czasie towarzyszy zanik 2 moli Fe
![]()
![]()
![]()
![]()
2)ΔnH2SO4 = -12 => ΔnFe = -4 ΔnFe2(SO4)3 = +2 ΔnSO2 = +6 ΔnH2O = +12
![]()
itd...
![]()
Przyrost postępu reakcji chemicznej (ξ):
![]()
wynik zawsze nieujemny, ponieważ znak licznika i mianownika jest taki sam!
dξ ![]()
0 (postęp reakcji jest dodatni lub równy 0)
![]()
pochodna (iloraz nieskończenie małych wartości)
definicja szybkości reakcji chemicznej
Elementy kinetyki chemicznej
Szybkość reakcji (w sensie półempirycznym):
- szybkość na podstawie substratu
![]()
← badanie dla reakcji o umiarkowanej szybkości
- szybkość w odniesieniu do produktu
![]()
Szybkość reakcji zależy od:
- temperatury - wzrost prowadzi do zwiększenia szybkości cząsteczek, a tym samym do zwiększenia szybkości reakcji (wzrost o 10oC - podwojenie, o 20oC - poczwórnie; reguła van't Hoffa)
- stężenia - ze wzrostem stężenia reagentów szybkość reakcji wzrasta
- katalizatorów - katalizatory dodatnie (promotory, aktywatory) zwiększają szybkość, ujemne (inhibitory) zmniejszają szybkość reakcji
- postaci krystalicznej stałego reagentu.
aA + bB + ............. ................ T = const
v = k ![]()
..........
k - stała szybkości reakcji chemicznej
(szybkość z jaką zachodzi reakcja przy
jednostkowych stężeniach reagentów)
aA + bB ↔ cC + dD
![]()
![]()
Stan równowagi chemicznej: ![]()
nie jest to stan statyczny, obie reakcje nadal biegną,
ale wypadkowa szybkość wynosi 0
![]()
=> ![]()
Stężenia równowagowe - stężenia reagentów w stanie równowagi
![]()
![]()
- stężenie równowagowe
![]()
= [A]
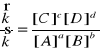
![]()
K - stała równowagi chemicznej
K(T) - wielkość stała jedynie w stałej remperaturze
reakcje endotermiczne ![]()
licznik rośnie szybciej
reakcje egzotermiczne ![]()
reakcje niezależne od temperatury = licznik i mianownik rosną tak samo
N2 + 3H2 ↔ 2NH3 + Q Q - ciepło
reakcja egzotermiczna (wydajność niższa im wyższa temperatura, szybkość rośnie)
K jest miarą wydajności reakcji
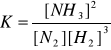
Dysocjacja elektrolityczna
Dysocjacja - proces, w którym powstają jony
Anoda - elektroda dodatnia
Katoda - elektroda ujemna
AnBm![]()
nAm+ + mBn-
n(+m) + m(-n) = 0
dla n = m = 1 => AB ↔ A+ + B- jony
w stanie równowagi chemicznej ![]()
cząsteczki
[A+] = [B-]
C - całkowite stężenie (liczba moli cząsteczek w 1dm3)
Stopień dysocjacji α - stosunek liczby cząsteczek zdysocjowanych do całkowitej liczby cząsteczek
![]()
0 - brak dysocjacji (całkowity nieelektrolit
0 ≤ α ≤ 1 1 - 100% cząsteczek zdysocjowanych
podział umowny:
α ≤ 0,3 - elektrolity słabe
0,3 < α ≤ 0,7 - elektrolity średnie
α > 0,7 - elektrolity mocne
[A+] = [B-] = c ∙ α
[AB] = c - c ∙ α = c(1 - α)
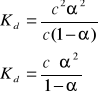
α ≈ 0 => 1 - α ≈ 1
Prawo rozcienczeń Ostwalda:
![]()
stopień dysocjacji jest tym mniejszy im większe jest stężenie; jego stosowalność jest bardzo ograniczona
(1 - α)Kd = c ∙ α2 Δ = b2 - 4ac
c ∙ α2 + Kdα - Kd = 0 ![]()
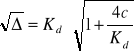
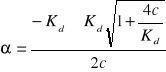
jedynym poprawnym fizycznie pierwiastkiem jest
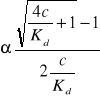
(a - b) (a + b) = a2 - b2
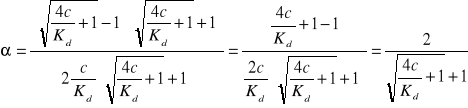
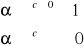
c 0 => 0
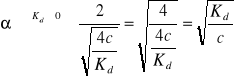
można pominąć jedynki, bo ta liczba jest bardzo duża
Jedynym słusznym kryterium mocy elektrolitów jest Kd, ponieważ jest niezależna od stężenia.
Kwasy i zasady
Teoria Arrheniusa:
- kwasem jest substancja, która dysocjując wydziela jony wodorowe.
HCl H+ + Cl-
H2SO4 2H+ + SO42-
- zasady dysocjując wydzielają jony wodorotlenkowe
KOH K+ + OH-
Ba(OH)2 Ba2+ + 2OH-
Teoria Bronsteda:
- kwasy to substancje, które mogą być donorami protonów; rozpuszczalnik jest równoważnym partnerem dysocjacji i musi być uwzględniony w równaniu
- zasada - akceptor protonu
kwas 1 zasada 2 zasada 1 kwas 2
CH3COOH + H2O ↔ CH3COO- + H3O+ reakcja protolizy
H3O+ - jon hydranowy (proton i jedna cząsteczka wody)
CH3COOH - kwas (donor protonu)
woda ma większe powinowactwo do protonu niż kwas octowy, więc mu go zabiera
Woda nie byłaby polarna, gdyby była liniowa
![]()
wiązanie spolaryzowane
moment dipolowy M = |δ| ∙ r r > 0 => M > 0
gdyby cząsteczka wody była liniowa to r = 0
z1 k2 k1 z2
NH3 + H2O ↔ NH4+ + OH-
Woda ma właściwości amfolityczne:
H2O + H2O ↔ H3O+ + OH- autojonizacja
S2- + H2O ↔ HS- + OH-
Każdy jon w roztworze wodnym jest hydratowany, więc Fe3+ będzie w wodzie wyglądał następująco:
[Fe(H2O)n]3+ n = zwykle 6, czasem 4
[Fe(H2O)n]3+ + H2O ↔ Fe(H2O)n-1OH]2+ + H3O+
[Fe(H2O)n-1OH]2+ + H2O ↔ [Fe(H2O)n-2(OH)2]+ + H3O+
[Fe(H2O)n-2(OH)2]+ + H2O ↔ [Fe(H2O)n-3(OH)3] + H3O+
W danym rozpuszczalniku kwasem jest ta substancja, która zwiększa stężenie kationów charakterystycznych dla autojonizacji tego rozpuszczalnika, a zasadą ta substancja, która zwiększa stężenie anionów.
NH3 + NH3 ↔ NH4+ + NH2-
(jon amidkowy)
H2S + H2S ↔ H3S+ + SH-
Kwasy Lewisa - kwasem jest akceptor elektronu, a zasadą donor.
Skala kwasowości
H2O + H2O ↔ H3O+ + OH-
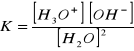
[H3O+] = [OH-] = 10-7 mld/dm3 (w temperaturze 20-25oC)
MH2O = 18 g/mol
![]()
[H2O] = const
pH = -log[H3O+]
pHH2O, 80st.C = 6, ale woda jest nadal obojętna, ponieważ [H3O+] = 10-6 i [OH-] = 10-6
pHH2O = 7 tylko w temperaturze 20-25oC
Iloczyn jonowy wody (Kw)
K[H2O]2 = [H3O+][OH-]
10-14 (10-7 ∙ 10-7)
Kw = [H3O+][OH-]
Roztwór obojętny - roztwór jonów hydronowych i hydroksylowych; wynosi po 10-7. W roztworze kwaśnym ![]()
, a w zasadowym ![]()
[H3O+] = 10-2 M roztwór kwaśny
10-2 + 10-12 = 10-14
[OH-] = 10-12 M roztwór kwaśny
![]()
![]()
pH roztworu = -log[H3O+]
roztwór obojętny [H3O+] = 10-7 pH = -log10-7 = 7
roztwór kwaśny [H3O+] = 10-2 pH = -log10-2 = 2
roztwór zasadowy [OH-] = 10-3 [H3O+] = 10-11 pH = -log10-11 = 11
Stała kwasowa i stała zasadowa
kwas
HA + H2O ↔ A- + H3O+
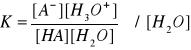
KKw = K∙[H2O]
![]()
stała kwasowa
B + H2O ↔ BH+ + OH-
![]()
stała zasadowa
A- + H2O ↔ HA + OH-
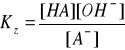
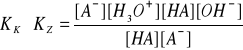
KK∙KZ = [H3O+][OH-]
KK ∙ KZ = KW
pOH = -log[OH-]
pH + pOH = 14
Podstawy działania wskaźników kwasowo-zasadowych
Indukcja (oznaczanie) kwasowości i zasadowości:
- indykatory kwasowo-zasadowe
- substancje, które mogą barwić się (zmieniać barwę) w zależności od kwasowości roztworów
- słabe kwasy lub słabe zasady organiczne; barwa ich roztworów wodnych w stanie niezjonizowanym jest inna niż w stanie zjonizowanym.
Indykator - słaby kwas organiczny
HInd + H2O ↔ Ind- + H3O+ Ind - reszta kwasowa indykatora
Barwa roztworu jest zależna od tego, która z form barwnych dominuje (zjonizowana czy niezjonizowana)
![]()
![]()
![]()
-log10 = p
![]()
Barwa przejściowa - barwa odpowiadająca jednakowym stężeniom obydwu form wskaźnika
pH* = pKK punkt przejścia (pH* - pH punktu przejścia; pH stanu barwy przejściowej)
Indykator - słaba zasada
Ind + H2O ↔ HInd+ + OH-
![]()
KW = [H3O+][OH-]
![]()
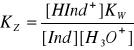
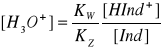
jeśli dominują cząsteczki sprotonizowane to barwa roztworu jest barwą charakterystyczną dla nich
pH = -logKW + logKZ - log![]()
KW = 10-14
pH = 14 - pKZ - log![]()
pH* = 14 - pKZ w punkcie przejścia![]()
wynosi 1 -log1 = 0, więc można to pominąć
obszar przejścia indykatora - przedział pH, którego środek stanowi punkt przejścia, a otoczenie stanowi jedna jednostka logarytmiczna w lewo/prawo.
OPI = pH* +/- 1
OP oranżu metylowego - 3,1-4,4 (ze względu na duży kontrast barw)
OP fenyloalaniny - 8,2-10
KK ∙ KZ = KW
Ind + H2O ↔ IndH+ + OH-
z1 k1
pH = 14 - pKZ - log![]()
pKK = 14 - pKZ
punkt przejścia uniwersalny pH* = pKK - log![]()
(ale trzeba ustalić co jest kwasem, a co zasadą)
Zastosowanie indykatorów w miareczkowaniu kwasowo-zasadowym:
- miareczkowanie mocnego kwasu mocną zasadą (do biurety lejemy kwas, a zasada jest w kolbie - chyba, że nie ma innego wyboru i do biurety trzeba nalać zasadę)
H3O+ + OH- ↔ 2H2O
VK* w pH obojętnym
nie ma znaczenia czy jako indykator zastosujemy oranż czy fenoloftaleinę, bo zarówno niedomiareczkowanie (fenoloftaleina), jak i przemiareczkowanie (oranż) dają błąd, który jest błędem akceptowanym
- miareczkowanie słabej zasady mocnym kwasem
NH3 + H3O+ ↔ NH4+ + H2O
z1 k1
NH4+ + H2O ↔ NH3 + H3O+
odczyn roztworu w pH* będzie lekko kwaśny
VK* w pH kwaśnym
indykator - oranż metylowy (popełniamy niewielki błąd)
- miareczkowanie słabego kwasu mocną zasadą
CH3COOH + OH- ↔ CH3COO- + H2O
k1 z1
odczyn w pH* umiarkowanie zasadowy
indykator - fenoloftaleina
Bufory kwasowo-zasadowe
Bufory - służą do zapewnienia łagodnych zmian pH. Układy zapewniające łagodne zmiany pH przy dodatku do roztworu niewielkich ilości mocnych kwasów lub zasad.
Przekroczenie pojemności buforowej - układ przestaje być buforem.
1dm3 H2O [pH = 7]
+
1cm3 1M H3O+ CH3O+ = 10-3 mol/dm3 [M]
pH = 3
1dm3 H2O
+
1cm3 1M OH- COH- = 10-3 M
pH = 11
Bufory to mieszaniny złożone ze słabej zasady i jej soli lub słabego kwasu i jego soli.
Mechanizm działania buforów
bufor octanowy = CH3COOH + CH3COONa (może być dowolny inny rozpuszczalny octan)
CH3COONa CH3COO- + Na+ (znaczenie marginalne)
CH3COOH + H2O ↔ CH3COO- + H3O+
dodatek mocnego kwasu (H3O+)
H3O+ + CH3COO- ↔ CH3COOH + 2H2O
słaby kwas,
składnik buforu
dodatek mocnej zasady (OH-)
CH3COOH + OH- ↔ CH3COO- + H2O
CH3COOH + H2O ↔ CH3COO- + H3O+
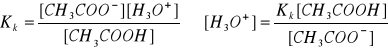
[CH3COOH] = Ck
[CH3COO-] = Cs
[H3O+] = Kk ∙ ![]()
![]()
rozcieńczenie roztworu buforowego nie powoduje zmiany pH, ponieważ licznik i mianownik ![]()
zmieniają się w tym samym stopniu
![]()
Rozcieńczanie zmniejsza pojemność buforową
Kk kwasu octowego = 1,8∙10-5
1o Ck = Cs Ck/Cs = 1 log1 = 0 pH = pKk = -log(1,8∙10-5) = 5 - log(1,8) ≈ 5 - 0,25 ≈ 4,75
2o Ck = 10Cs Ck/Cs = 10 log10 = 1 pH = 4,75 - 1 = 3,75
3o Ck = 0,1Cs Ck/Cs = 0,1 log0,1 = -1 pH = 4,75 - (-1) = 5,75
![]()
(ponieważ CZ to to samo, co CS)
bufor amoniakalny = NH3 + NH4Cl
NH4Cl NH4+ + Cl- (znaczenie marginalne)
H3O+ + NH3 ↔ NH4+ + H2O
OH- + NH4+ ↔ NH3 + H2O
NH3 + H2O ↔ NH+ + OH-
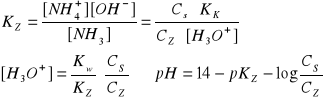
KZ NH3 = 1,8∙10-5
1o CS = CZ CS/CZ = 1 log1 = 0 pH = 14-4,75 = 9,25
2o CS = CZ = 10 pH = 9,25 - 1 = 8,25
3o CS/CZ = 0,1 pH = 9,25 + 1 = 10,25
NH4+ + H2O ↔ NH3 + H3O+
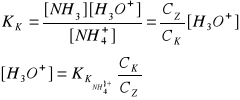
bufor fosforanowy - ciekła mieszanina zawierająca dwa fosforany
H3PO4 H2PO4- HPO42-
diwodorofosforan monowodorofosforan
H2PO4- + H2O ↔ HPO42- + H3O+
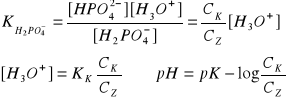
KK = 10-1
środowisko umiarkowanie obojętne
![]()
Rozpuszczalność soli trudnorozpuszczalnych
Halogenki srebra - sole bardzo trudno rozpuszczalne
Roztwór nasycony:
- roztwór o maksymalnym (w danych warunkach) stężeniu
- istnieją sposoby na uzyskanie roztworu przesyconego, ale nie pozostaje on w równowadze termodynamicznej, natomiast nasycony pozostaje w równowadze termodynamicznej z fazą stałą tej substancji
(AgCl)st ↔ Ag+ + Cl-
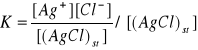
(← wielkość stała w przypadku równowagi między fazą stałą a roztworem)
K[(AgCl)st] = [Ag+][Cl-]
Iloczyn rozpuszczalności (I)
IAgCl = [Ag+][Cl-]
Rozpuszczalność (S) - stężenie molowe roztworu nasyconego
SAgCl = 10-5 mol/dm3
[Ag+] = [Cl-] = 10-5 mol/dm3
IAgCl = 10-5 ∙ 10-5 = 10-10
![]()
SAgI = 10-8 mol/dm3
IAgI = 10-16
(Ag2CrO4)st ↔ 2Ag+ + CrO42-
![]()
I = (2s)2 ∙s = 4s3
↑
jedna rozpuszczona część
daje dwa jony Ag
![]()
![]()
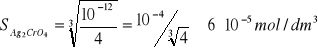
„I” może być kryterium porządkującym S gdy poszczególne cząsteczki substancji dysocjują na tą samą liczbę jonów; gdy substancja dysocjuje na różną liczbę jonów to kryterium jest wyłącznie S.
Argentometria:
- analiza strąceniowa ze związkami srebra
- np. do określenia ilości chlorków w produkcie - miareczkowanie mianowanym roztworem srebra (mianowany = o znanym stężeniu)
Ag+ + Cl- AgCl↓
- indykator - roztwór chromiany potasu (barwa żółta; badany roztwór staje się lekko żółtawy); wytrąca się chlorek (chromian srebra się nie wytrąci póki nie wytrąci się AgCl); od jednej kropli nadmiaru chromianu potasu roztwór robi się ciemnoczerwony (od wytrąconego chromianu srebra) ← metoda bezpośrednia (Mohra).
Procesy utleniania i redukcji
Utlenianie - proces „odbierania” elektronów (dezelektronacja); podwyższenie ładunku dodatniego substancji ulegającej utlenianiu.
Redukcja - powiększenie puli elektronów substancji ulegającej redukcji.
Utlenianie i redukcje są wzajemnie sprzężone. Substancja redukowana jest utleniaczem dla reduktora.
KMnO4 K+ + MnO4- (← jeden z najsilniejszych utleniaczy)
MnO4- + H2C2O4 = CO2 + Mn2+
kwas szczawiowy,
słaby
UZUPEŁNIĆ REAKCJAMI Z ZESZYTU!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! (są w dwóch różnych wykładach!!!!!!!!!!)
Potencjał redukująco-utleniający - wzór Nernsta; substancja charakteryzująca się wyższą wartością potencjału Nernsta jest utleniaczem w stosunku do substancji o niższej wartości potencjału.
αutl + ne + k[H3O+] = βred + mH2O
Równanie Nernsta:
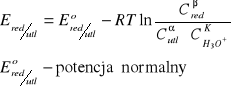
R - stała gazowa
T - temperatura bezwzględna
n - liczba elektronów
F - stała Faradaya (ładunek, który musi przepłynąć przez roztwór, aby zredukować 1M 1+ kationów) ≈ 96500 cul/mol ładunków jednododatnich
w temperaturze pokojowej
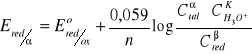
Eo - wartość potencjału Nernsta, gdy C wszystkich reagentów procesów redukcyjnych będą jednostkowe; tam, gdzie są produkty gazowe można stężenia zastąpić ciśnieniami
Normalne półogniwo wodorowe
redukcja 2H3O+ + 2e = H2 + 2H2O
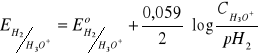
= 0V = 0
(umownie 0)
I II
E = -1,8V E = -3,75V układ o wyższej wartości E jest utleniaczem
utleniacz reduktor
Jeśli potencjał redoksowy metalu jest niższy niż potencjał elektrody zanurzonej w wodzie, to metal wypiera wodór z wody.
![]()
← minimalny potencjał metalu mogącego wyprzeć wodór z wody
![]()
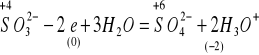
![]()
← dla równania Nernsta
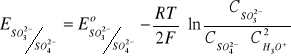
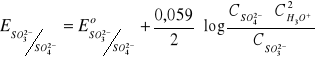
↑
dla interwału 20-25oC
Półogniwa I rodzaju - półogniwa odwracalne ze względu na kation
Men+ + ne- ↔ Me
równowaga między roztworem a metalem
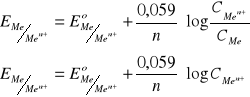
Półogniwa II rodzaju - półogniwa odwracalne ze względu na anion
Cl2 + 2e- ↔ 2Cl-
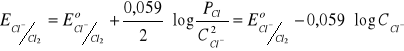
Półogniwa III rodzaju - półogniwa redukująco-utleniające (materiał elektrody aktywnie uczestniczy w równowadze materiał-roztwór).
Ogniwa elektrochemiczne
Ogniwa - układy dwóch półogniw; jeśli ich potencjały się różnią to mamy przepływ prądu elektrycznego. Pracują na zasadzie utleniania i redukcji.
![]()
![]()
siła elektromotoryczna (SEM) = napięcie
SEM = Eutl - Ered ≥ 0
MnO4- + 5e + 8H3O+ = Mn2+ + 12H2O
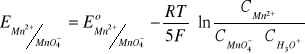
H2O2 - 2e + 2H2O = O2 + 2H3O+
O2 + 2e + 2H3O+ = H2O2 + 2H2O
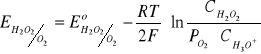
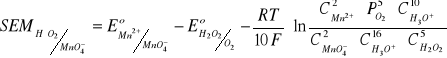
↓
normalna siła elektromotoryczna
(![]()
)
2MnO4- + 10e + 16H3O+ + 5H2O2 - 10e + 10H2O = 2Mn2+ + 24H2O + 5º2 + 10H3O+
2MnO4- + 6H3O+ + 5H2O2 = 2Mn2+ + 14H2O + 5O2
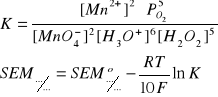
K jest niezależne od stężenia (perpetum mobile - tak być nie może!)
Prąd płynie dlatego, iż układ nie jest w stanie równowagi
![]()
Cr [r]
![]()
![]()
Promieniotwórczość
Jądro - nukleony (proton + neutron); jest nośnikiem praktycznie całej masy atomu (nukleon jest cięższy od elektronu ok. 24x).
Liczba protonów - liczba atomowa (porządkowa).
Liczba masowa - sumaryczna liczba protonów i neutronów.
Izotopy - jądra (atomy) mające rą samą liczbę atomową, ale różniące się liczbą neutronów. Izotopy wodoru - H, D (deuter), T (tryt)
![]()
Izobar - atomy o tej samej liczbie masowej, ale różniące się liczbami atomowymi.
Izotony - mają identyczne liczby neutronów w jądrze.
Masa atomowa - ważona średnia pomiędzy izotopami danego atomu
![]()
Promieniowanie α:
- mają charakter korpuskularny; są to podwójnie zjonizowane atomy helu
![]()
![]()
- cząstka α
- pierwsze prawo przesunięć
Promieniowanie β:
![]()
- prawo rozpadu promieniotwórczego
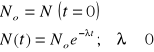
λ - stała rozpadu promieniotwórczego (im jest większa tym szybszy rozpad; λ = 0 - pierwiastki trwałe, brak promieniotwórczości).
Promieniowanie γ - skutek rozpadu cząstek α lub β
Czas połowicznego zaniku radioizotopu - czas, po którym z wyjściowej liczby nuklidów zostaje połowa.
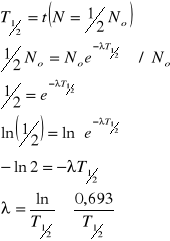
Pierwiastek niepromieniotwórczy - jest promieniotwórczy, ale T1/2 jest nieskończenie długi.
![]()
Budowa materii
me- ≈ 9∙10-31 kg
mp = mn = 10-27 kg
![]()
de- = 10-13 m
dp = dn = 10-15 m
Postulaty Bohra
1o ![]()
h - stała Plancka (6,62∙10-34 J∙s)
n (liczba kwantowa) = 1, 2, 3, ...
2o elektron może dokonywać przeskoków pomiędzy orbitalami dozwolonymi
n m Em > En
Δ En m = hν
Budowa atomu
Liczby kwantowe:
- n - główna liczba kwantowa (1, 2, 3, ...; K, L, M, ...)
- l - poboczna liczba kwantowa; 0 (s), 1 (p), 2, (d), 3 (f), ..., (n-1); miara deformacji orbity (im wyższa wartość l, tym bardziej płaska orbita)
- ml - magnetyczna liczba kwantowa; ml = -l, -(l-1), ..., 0, 1, ..., +l
- ms - spinowa liczba kwantowa; ms = ±1/2
Zakaz Pauliego - w danym atomie nie mogą występować dwa lub więcej elektronów o identycznych wszystkich liczbach kwantowych
Struktura układu okresowego pierwiastków chemicznych
Reguła Hunda
Powłoka walencyjna
1H: 1s1
2He: 1s2
3Li: 1s2 2s1
4Be: 1s2 2s2
5B: 1s2 2s2 2p1
6C: 1s2 2s2 2p2
7N: 1s2 2s2 2p3
8O: 1s2 2s2 2p4 (2s2)
9F: ... 2s2 2p5
10Ne: ...2s2 2p6
gaz szlachetny
11Na: [Ne] 3s1
12Mg: [Ne] 3s2
Ar: [Ne] 3s2 3p6
K: [Ar] 4s1
Ca: [Ar] 4s2
Sc Ti V Cr Mn Fe Co Ni Cu Zn [Ar] 4s2 3d1-10
Cu, Cr - pierwiastki przejściowe
Promocja
Cr
Cu
(zamiast
)
Ga Ge As Se Br Kr 4s2 4p1-6
Kr [Ar]* 4s2 4p6
Rb Sr
5s1 5s2
Xe [Kr]* 5s2 5p6
Uran - najcięższy pierwiastek naturalny; kończy wszystkie pierwiastki występujące w naturze.
Transuranowcy - pierwiastki leżące za uranem, otrzymane wyłącznie sztucznie.
Kształty orbitali
Struktura cząsteczki wody
H: 1s1
O: 2s2 2p4
Hybrydyzacja tetraedryczna - zmieszanie orbitali (tworzenie hybrydy): 2s 2p sp3
Struktura tetraedryczna
Jon hydronowy H3O+
Wiązanie sigma - wiązanie między nakładającymi się orbitalami wzdłuż ich osi symetrii.
Wiązanie pi - boczne nakładanie się orbitali nieshybrydyzowanych.
W związkach, w których występuje wiązanie podwójne występuje jedno wiązanie sigma i jedno pi.
1s + 1p 2sp - hybrydyzacja liniowa (digonalna); daje wiązanie podwójne, a jednocześnie liniowy kształt cząsteczki
dsp2 - hybrydyzacja kwadratowa; wszystkie orbitale leżą w jednej płaszczyźnie i są skierowane w narożniki kwadratu
6d2sp3 - hybrydyzacja heksagonalna
23
Wyszukiwarka
Podobne podstrony:
fizjo wykłady, Fizjoterapia CM UMK, Fizjoterapia ogólna
cw 2, Dietetyka CM UMK, Chemia ogólna i żywności
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
ćw.3 -alkacymetria, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I
ćw.1 kompleksy, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I sem
ćw.2 roztw.stęż, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
egzamin chirurgia 2(1), Dietetyka CM UMK, Chirurgia
odpowiedzi - parazyty, Dietetyka CM UMK, Parazyty
propedeutyka słowka I, Fizjoterapia CM UMK, Fizjoterapia ogólna
Bioetyka- wykłady, FIZJOLOGIA CM UMK, BIOLOGIA CM UMK, ATLASY ANATOMIA CM UMK BYDG, ANATOMIA COLLEGI
BIOCHEMIA - wykad 13.04. Metabolizm żelaza, Dietetyka CM UMK, Biochemia
Chirurgia-test, Dietetyka CM UMK, Chirurgia
CHOROBY UKŁADU POKARMOWEGO (2), Dietetyka CM UMK, Choroby wewnętrzne
więcej podobnych podstron