Szczecin 14.12.99
Marcin Sarniak I TM Ab
SPRAWOZDANIE Z ĆWICZEŃ LABORATORYJNYCH
Z CHEMII NIEORGANICZNEJ
Temat: Elektroliza
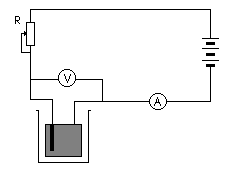
Doświadczenie
Do elektrolizera podłączono wg schematu przygotowane elektrody. Jako roztwór badany zastosowano siarczan (VI) miedzi (II) CuSO . Następnie do roztworu badanego dodano ok. 2 cm³ stężonego kwasu siarkowego (VI) H SO i 2-3g azotanu (V) amonu NH NO .
W rozgrzanym do temperatury 80°C roztworze zanurzono elektrody platynowe włączone do elektrolizera i przeprowadzono elektrolizę przy napięciu U = 3-4 V z zastosowaniem mieszania magnetycznego.
Po upływie ok. 30 minut, kiedy roztwór uległ odbarwieniu i wydzieleniu się z roztworu prawie całej ilości miedzi, zwiększono napięcie do 4,2 V i obserwowano proces elektrolizy przez następne ok. 15 minut.
Omówiono i zademonstrowano sposoby sprawdzenia obecności miedzi w roztworze:
dodanie niewielkiej ilości wody lub zanurzenie elektrod głębiej i zaobserwowanie powstawania na świeżo zanurzonej powierzchni elektrody nowej warstwy miedzi
dodanie 2 kropel z elektrolitu na bibułkę i 1 kroplę sześciocyjanożelazianem (III) potasu K [Fe(CN) ]; kolor jasnobrunatny świadczy o obecności miedzi w roztworze
Omówiono także zastosowanie elektrolizy w przemyśle.
Po zakończeniu elektrolizy wyjęto katodę z wydzieloną miedzią i przemyto ją wodą. Następnie odłączono prąd. Zanurzono katodę w alkoholu i suszono ją ok. 3 minut. Usunięto miedź z elektrody poprzez zanurzenie jej w roztworze kwasu azotowego (V) HNO pod wyciągiem. Elektrodę spłukano wodą destylowaną i alkoholem.
Wyszukiwarka
Podobne podstrony:
Elektroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
elektroliza1, Szkoła, penek, Przedmioty, Chemia, Teoria
Silownie i elektrownie1, Szkoła, penek, Przedmioty, Elektrotechnika, Zaliczenie
Wyznaczanie prędkości dźwięku metodą składania drgań elektrycznych 2, Szkoła, penek, Przedmioty, Fiz
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Roztwory, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.3, Szkoła, penek, Przedmioty, Chemia, Laboratoria
KOROZJA1, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Hydroliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Ćw.ch.4, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Pierwiastki 2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Redox2, Szkoła, penek, Przedmioty, Chemia, Laboratoria
więcej podobnych podstron