 | Pobierz cały dokument analiza.chem.i.rozpuszczxalnosc.1.semestr.wis.doc Rozmiar 415 KB |
Reakcje w roztworach wodnych c.d.
Analiza wagowa i objętościowa
Analiza wagowa
Zasadą analizy wagowej jest wytrącenie z roztworu osadu zawierającego oznaczany składnik. Po obróbce osadu (mycie, suszenie, prażenie), znając jego wzór a więc i skład chemiczny, można wyliczyć zawartość oznaczanego składnika w próbce. Dla ułatwienia tych obliczeń stosuje się tzw. mnożniki analityczne (stechiometryczne). Poniżej przedstawiono sposób obliczania mnożnika analitycznego dla wagowego oznaczania żelaza.
Przykład 1
Wagowe oznaczanie żelaza polega najczęściej na wytrącaniu z próbki osadu wodorotlenku żelaza(III):
![]()
Osad wodorotlenku po odsączeniu oraz przemyciu praży się, w wyniku czego otrzymuje się trwały chemicznie osad tlenku żelaza(III), który po zważeniu umożliwia wyliczenie zawartości żelaza w uzyskanym trwałym osadzie. Wyliczenie zawartości żelaza (x) polega na rozwiązaniu proporcji:
2 Fe : ![]()
gdzie: m - masa zważonego osadu
x - poszukiwana masa żelaza
Fe - masa molowa żelaza 56 g/mol
![]()
- masa molowa tlenku żelaza(III) 160 g/mol
![]()
wartość ilorazu 2Fe/![]()
nosi nazwę mnożnika analitycznego; dla tego sposobu wyliczenia ilości żelaza wynosi przykładowo 0,6994.
W trakcie wykonywania oznaczenia można korzystać z mnożników analitycznych zebranych w tablicach analitycznych, lub też wyliczać je na podstawie odpowiednich równań reakcji czy też znajomości wzorów chemicznych związków tworzących osad. Ilość składnika oznaczanego oblicza się z iloczynu mnożnika analitycznego i masy osadu. Jeżeli przykładowo w wyniku analizy wagowej na zawartość żelaza uzyskano osad tlenku żelaza(III) o masie 0,1258 g, to ilość zawartego w nim żelaza wynosi: x= 0,6994 · 0,1258 g = 0,0880 g żelaza
Znając masę analizowanej próbki, można dalej obliczyć zawartość procentową żelaza w badanym materiale lub też wykonać inne obliczenie.
Przykład 2
Ile 2-molowego roztworu amoniaku należy użyć do całkowitego wytrącenia z próbki około 0,1 g żelaza, jeżeli zaleca się stosowanie 3-krotnego nadmiaru molowego amoniaku względem żelaza.
![]()
![]()
![]()
Ilość amoniaku można wyliczyć z proporcji:
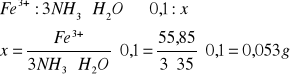
Uwzględniając trzykrotny nadmiar 3·0,053 = 0,159 g amoniaku, co po przeliczeniu na objętość 2-molowego roztworu daje:
1000 ![]()
2-molowego roztworu zawiera 50 g amoniaku
x ![]()
2-molowego roztworu zawiera 0,159 g amoniaku,
x = 2,3 ![]()
roztworu amoniaku
Przykład 3
 | Pobierz cały dokument analiza.chem.i.rozpuszczxalnosc.1.semestr.wis.doc rozmiar 415 KB |