cw jpeg

Dr Beata Just-Brochocka Katedra Chemii
Wydział Nauk o Żywieniu Człowieka i Konsumpcji Pytania treningowe nr 2
1.
2.
3.
4.
Pośród nuklidów opisanych odpowiednimi liczbami atomowymi i masowymi, wskaż: izotopy, izobary i izotony.
12
6
X >
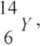
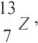
13 14
6P’7W'
Uran 238 (1. at.92) traci w dwóch kolejnych przemianach po jednej cząstce a, a następnie trzy cząstki p. Podaj liczbę atomową i masową nuklidu powstałego w wyniku tych przemian.
Podaj liczbę atomową i masową pierwiastka X powstałego z radonu (^ Rn) w
wyniku jednokrotnej samorzutnej przemiany a i jednokrotnej przemiany p-.
Podaj liczby atomowe i masowe pierwiastków oznaczonych symbolami literowymi.
Z "K" > Y ° > 232 x <- P W — R 82
5. Po jakim czasie, z próbki promieniotwórczego izotopu, którego okres połowicznego rozpadu wynosi 8 godzin, pozostanie 25 %jego pierwotnej masy ? Odp: 16 godzin
6. Po upływie 55 minut z 0,200 g izotopu l3N pozostało 6,25 mg . Ile wynosi okres półtrwania tego izotopu ? Odp. ok. 11 minut
7. Po upływie 1,25 h z 0,0200 g izotopu ljN pozostało 0,2 mg tej próbki. Oblicz okres półtrwania tego izotopu. Odp. ok. 0,19 h
8. Ile miligramów promieniotwórczego izotopu pierwiastka X pozostanie po 12 h z próbki o masie 50 mg, jeśli wiadomo, że jego okres półtrwania wynosi 8 godzin Odp. 18 mg
9. Jaka była początkowa masa promieniotwórczego izotopu pewnego pierwiastka, którego okres półtrwania wynosi 2 h jeśli po 15 minutach pozostało go 120 mg ? Odp. 131 mg
10. Podaj wartości wszystkich liczb kwantowych elektronów walencyjnych atomów: potasu, magnezu, glinu, węgla ...
11. Podaj liczbę atomową pierwiastka, którego elektrony walencyjne opisane są jako: a/
4s2,3d3; b/ 3s2,3p2.....
12. Zapisz konfigurację elektronową atomów pierwiastka o liczbie atomowej 20, 33 48,.... Podaj jego położenie w układzie okresowym oraz przewidywane stopnie utlenienia.
13. Przedstaw konfigurację elektronową atomu pierwiastka leżącego w: a/ III okresie i V grupie głównej, b/ IV okresie i VI grupie pobocznej, c/...
14. Atomy pewnego pierwiastka mają 2 elektrony walencyjne opisane następującymi wartościami liczb kwantowych: n=5; 1=0; m=0; s=+l/2; s=-l/2. Zapisz konfigurację elektronową tego pierwiastka. Podaj wartość jego liczby atomowej.
Wyszukiwarka
Podobne podstrony:
treningowe jpeg Dr Beata Just-Brochocka Katedra Chemii
zad tr5 jpeg Dr Beata Jusl-Bróchocka Katedra Chemii Wydział Nauk o Żywieniu Człowieka i Konsumpcji P
chemiazadania1 Dr Beata Just-Brochocka Katedra Chemii Wydział Nauk o Żywieniu Człowieka i Konsumpcji
chemia cw treningowe Dr Beata Just-Brochocka Katedra Chemii Wydział Nauk o Żywieniu Człowieka i Kons
45660 zadania treningowe 8 3 Dr Beata Just-Brochocka Katedra Chemii Wydział Nauk o Żywieniu Człowie
Chemia Pytania treningowe 3 4 Dr Beata Just-Brochocka Katedra Chemii Wydział Nauk o Żywieniu Człowie
chemiazadania2 Dr Beata Just-Brochocka Katedra ChemiiWydział Nauk o Żywieniu Człowieka i Konsumpcji
zadania treningowe8 Dr Beata Just-Hrochocka Katedra ChemiiWydział Nauk o Żywieniu Człowieka i Konsum
więcej podobnych podstron