P1120620 [1024x768]
214
Wykonanie ćwiczenia
1. Przygotować serie roztworów o następujących stężeniach jonów Cl": 101,3*10"\ 10 J, 3*10 ,I0~\ 3*10 ,10A310'5,10"5,3*10 , 10'® M.
2. Zaczynając od roztworu najbardziej rozcieńczonego, zmierzyć potencjał chlor* kowej elektrody jonoselektywnej względem elektrody odniesienia (elektroda kalo-molowa i chlorosrcbrowa mogą być wprowadzane do badanego roztworu tylko przez klucz elektrolityczny wypełniony roztworem KNOj III).
3. Zmierzyć potencjał chlorkowej elektrody jonoselektywnej względem elektrody odniesienia w 50 cm' (odmierzonych dokładnie pipetą) roztworu KCI o stężeniu 3-I0 4 M, a następnie po każdorazowym dodatku 0.5 cm3 roztworu KCI o stężeniu 10~2 M (dodać 8 porcji wzorca).
Opracowanie wyników
1. Narysować stężeniową krzywą wzorcową chlorkowej elektrody jonoselektywnej £ = /HogcQ_).
2. Obliczyć nachylenie S krzywej kalibracji, E° oraz podać zakres prostoliniowo-ści i granicę oznaczalności.
3. Znając nachylenie krzywej kalibracji S, obliczyć stężenie jonów Cl w roztworze wyjściowym, korzystając ze zmierzonych wartości potencjałów E:
a) po dodaniu OJ cm3 roztworu wzorcowego,
b) po dodaniu 3.0 cm' roztworu wzorcowego.
Obliczenia wykonać według wzorów z pominięciem i uwzględnieniem efektu rozcieńczenia.
4. Obliczyć stężenie jonów chlorkowych w roztworze wyjściowym według metody dwukrotnego dodatku wzorca:
a) dla AK* 0.5 cm3,
b) dla AK = 2.0 cm3.
Wartości Z podano w tabeli I.
5. Narysować zależność (Vp+ Vw) \0ES=J{Vw) i z przecięcia prostej z osią K„ (prosta przecina oś po stronie ujemnych wartości Vw), obliczyć stężenie jonów Cl' według równania:
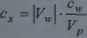
gdzie: |KM.| jest bezwzględną wartością objętości odczytanej z wykresu, c w - stężeniem wzorca, a Vp -objętościąpoczątkową próbki.
5. Przeanalizować uzyskane wyniki.
Wyszukiwarka
Podobne podstrony:
P1120614 [1024x768] 169 Wykonanie ćwiczenia 1 1. Zestawić układ do miareczkowania.
[I2]0 1 A b -a,J___1 K[Ar]0a2. WYKONANIE ĆWICZENIA 2.1 Przygotowanie mieszanin roztworów jodu i
IV Wykonanie ćwiczenia 1. Przygotowanie roztworów wzprconych. Do 7 kolb miarowych
2. Wykonanie ćwiczenia 1. Przygotować kartę pomiarową umożliwiającą zanotowanie
Ćwiczenie 4: Rejestracja i analiza widm EPR. Wykonanie ćwiczenia 6. Przygotowanie
WYKONANIE ĆWICZENIA 1. Wzorcowanie a). Sporządzić roztwory nisko - dyspersyjnych
WYKONANIE ĆWICZENIA Przygotowanie próbki (wykonane w okresie przygotowania ćwiczenia) Odważyć 2 g
P1120626 [1024x768] 124 Opracowanie wyników m m 1. Obliczyć pH roztworów, przyjmuj
4. Wykonanie ćwiczenia 1. Korzystając z wyjściowego roztworu oraniu metylowego
3. Wykonanie ćwiczenia 3.1 Przygotowanie
CCF20111016�010 3. Wykonanie ćwiczenia Przygotowanie próbki Odważyć do zlewki 40 g wskazanej przez p
P1120607 [1024x768] Wykonanie ćwiczenia I. Napełnić naczyńko pomiarowe roztworem 0.01 M KCI, którego
więcej podobnych podstron