87324
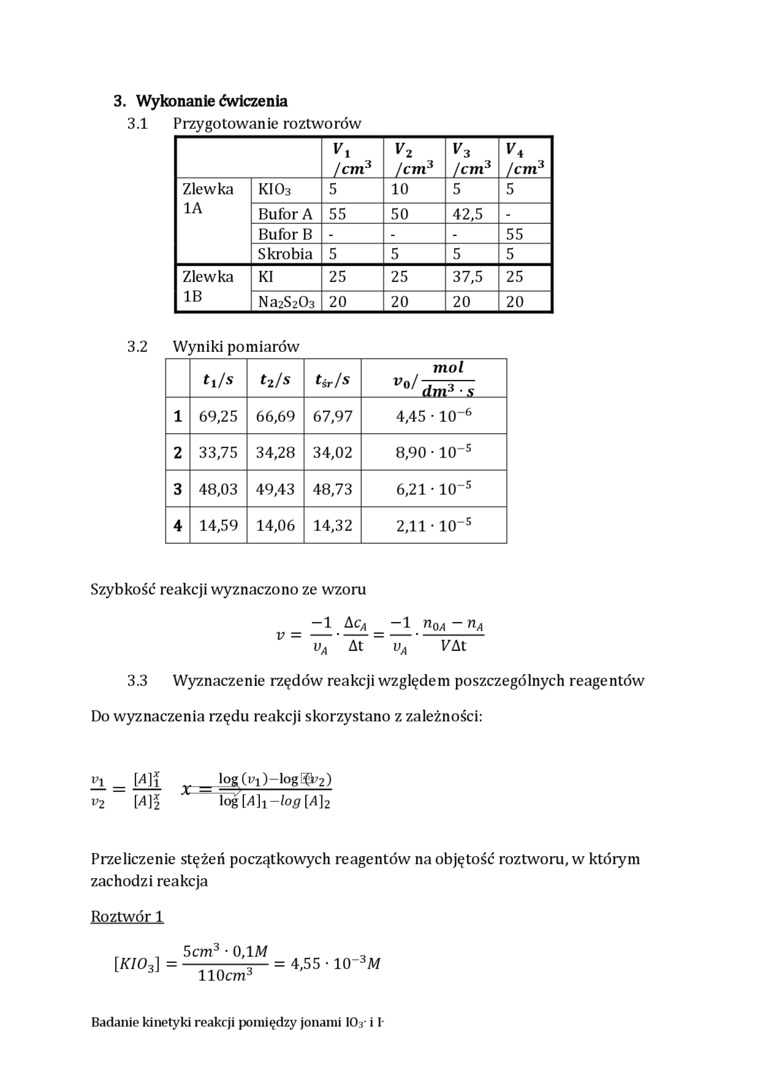
3. Wykonanie ćwiczenia
3.1 Przygotowanie roztworów
|
Vi /cm3 |
V2 /cm3 |
V3 /cm3 |
^4 /cm3 | ||
|
Zlewka 1A |
KI03 |
5 |
10 |
5 |
5 |
|
Bufor A |
55 |
50 |
42,5 |
- | |
|
Bufor B |
- |
- |
- |
55 | |
|
Skrobia |
5 |
5 |
5 |
5 | |
|
Zlewka IB |
KI |
25 |
25 |
37,5 |
25 |
|
Na2Sz03 |
20 |
20 |
20 |
20 | |
3.2 Wyniki pomiarów
|
ti/s |
t2/s |
Ur/s |
mol V°^ dni3 • s | |
|
1 |
69,25 |
66,69 |
67,97 |
4,45 • 10"6 |
|
2 |
33,75 |
34,28 |
34,02 |
8,90 • 10~s |
|
3 |
48,03 |
49,43 |
48,73 |
6,21 • 10-5 |
|
4 |
14,59 |
14,06 |
14,32 |
2,11 • 10'5 |
Szybkość reakcji wyznaczono ze wzoru
_ -1 &cA _ -1 n0A - nA vA At vA KAt
3.3 Wyznaczenie rzędów reakcji względem poszczególnych reagentów Do wyznaczenia rzędu reakcji skorzystano z zależności:
21 _ MJi _ log(^i)-log^2)
v2 [A)\ \og[A)i-log [A)2
Przeliczenie stężeń początkowych reagentów na objętość roztworu, w którym zachodzi reakcja
Roztwór X
[KI03] =
5cm3 • 0,1 M llOcm3
4,55 • 10"3M
Badanie kinetyki reakcji pomiędzy jonami 103* i I*
Wyszukiwarka
Podobne podstrony:
2. Wykonanie ćwiczenia 1. Przygotować kartę pomiarową umożliwiającą zanotowanie
IV Wykonanie ćwiczenia 1. Przygotowanie roztworów wzprconych. Do 7 kolb miarowych
Ćwiczenie 4: Rejestracja i analiza widm EPR. Wykonanie ćwiczenia 6. Przygotowanie
WYKONANIE ĆWICZENIA Przygotowanie próbki (wykonane w okresie przygotowania ćwiczenia) Odważyć 2 g
P1120620 [1024x768] 214 Wykonanie ćwiczenia 1. Przygotować serie roztworów o nastę
CCF20111016�010 3. Wykonanie ćwiczenia Przygotowanie próbki Odważyć do zlewki 40 g wskazanej przez p
[I2]0 1 A b -a,J___1 K[Ar]0a2. WYKONANIE ĆWICZENIA 2.1 Przygotowanie mieszanin roztworów jodu i
Ćwiczenie 2 Przygotuj cement tlenkowo-cynkowo-eugenolowy. Omów jego właściwości. Sposób wykonania
s 129 129 Wykonanie ćwiczenia W zlewkach o pojemności 100 ml przygotować roztwory zawierające jodan
s 129 129 Wykonanie ćwiczenia W zlewkach o pojemności 100 ml przygotować roztwory zawierające jodan
Synteza Octan amylu S-l Przed wykonaniem ćwiczenia student powinien przygotować zestawienie
więcej podobnych podstron