skanowanie0001

22. BADANIE ATOMOWYCH WIDM EMISYJNYCH
GAZÓW I METALI
Atom wodoropodobny
Atomem wodoropodobnym nazywamy atom złożony z jądra obdarzonego dodatnim ładunkiem Ze (gdzie Z jest liczbą naturalną, a e oznacza wartość ładunku elementarnego) oraz krążącego wokół niego elektronu. Zgodnie z teorią Bohra elektron w atomie może poruszać się tylko po ściśle/ określonych orbitach stacjonarnych, dla których spełniony je^t warunek:
L = m v r = n , (22.1®
gdzie . L oznacza moment^^pędu,. elektronu krążącego po danej orbicie, m jego masę, v - prędkość liniową elektronu w ruchu po orbicie, r - promień orbity5, h - stałą Plancka^ n - tzw. główną liczbę kwantową określającą orbitę, na której znajduje się elektron (n może przyjmować wartości całkowite, dodatnie
9 2—^^B .i,li B B
Energia elektronu w atomie może przyjmować tylko ściśle określone, dyskretne wartości E^, - E2,..., Er odpowiadające
kolejnym wartościom głównej liczby kwantowej n, a więc kolejnym orbitom elektronowym.
Wartość energii ER stanu elektronowego opisanego główną liczbą kwantową n można łatwo obliczyć korzystając z równania (22.1) oraz z faktu, iż w przypadku orbity stacjonarnej.
• i• dośrodkowy działającą na elektron jest siła oddziaływania hyiombOWBkiego pomiędzy jądrem atomowym a elektronem. Wartość ■iim• i ij I i E opisuje następujący wzór:
(22.2)
E = - 7,2 e4 m
n ' 8c2h2n2
o
-i*l.-.ii) cq oznacza przenikalność elektryczną próżni.
Krążąc po danej orbicie stacjonarnej elektron nie zmienia iwoJoj energii.
s Emisja promieniowania elektromagnetycznego występuje tylko i * i my przejściu elektronu ze stanu stacjonarnego o większej minr^ii Ej do innego stanu stacjonarnego o mniejszej energii M,. Podczas takiego przejścia emitowany jest kwant energii |ii'H (foton) o częstotliwości y j^ określonej wzorem:
v
ji
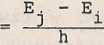
(22.3)
na
w wyniku

Przejście elektronu z orbity o mniejszej energii Orbitę o większej energii Ej jest możliwe jedynie nlisorpcji fotonu o energii równej różnicy energii Ej
Widmo promieniowania atomu wodoropodobnego
Korzystając z (22.2) oraz (22.3) możemy znaleźć wzór określający częstotliwość promieniowania emitowanego lub absorbowanego przez atom wodoropodobny przy przejściu ze stanu opisanego główną liczbą kwantową nj do stanu opisanego liczbą
ni ? ■■ i i
cR Z" oo
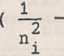
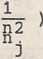
(22.4)
gdzie c oznacza prędkość propagacji światła w próżni, natomiast
Wyszukiwarka
Podobne podstrony:
49 (176) 22. BADANIE ATOMOWYCH WIDM EMISYJNYCH GAZÓW I METALI Atom wodoropodobny Atomem wodoropodobn
37 (217) 22. BADANIE ATOMOWYCH WIDM EMISYJNYCH GAZÓW I METALI Atom wodoropodobny Atomem wodoropodobn
IMAG0100 (5) I Badanie widma emisyjnego gazów. Wyznaczanie nieznanych długości fal K I. Wymagania do
DSC06182 METODY EMISYJNE Atomowa spektrometria emisyjna (AES) Rodzaje widm emisyjnych: Widmo c^gie -
DSC00233 (20) Badanie widma emisyjnego gazów. Wyznaczanie nieznanych długości fal1. &nbs
Ćwiczenie 47 Badanie widma emisyjnego gazów. Wyznaczanie nieznanych długości faliI. Zagadnienia do
Absorpcja Na gruncie modelu Bohra można łatwo zrozumieć własności widm emisyjnych atomów
22 Badania wszechświata. lub całkowitego zaćmienia słońca, to w każdym razie, ilekroć zaćmienie
skanowanie0020 Wynik badania radiologicznego klatki piersiowej może być prawidłowy, lub - zależnie o
skanowanie0022 22 • Przydatne obliczenia 2. Dodatkowe Informacje potrzebne przy MONTAŻU W DACHU STRO
skanowanie0025 (22) ^ At fatiO fiwch/rt S/f/o/JOi I ś C &/?& f M/ich/rt //
więcej podobnych podstron