skanuj0061
120
120
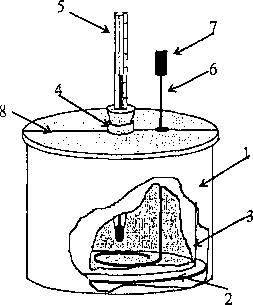
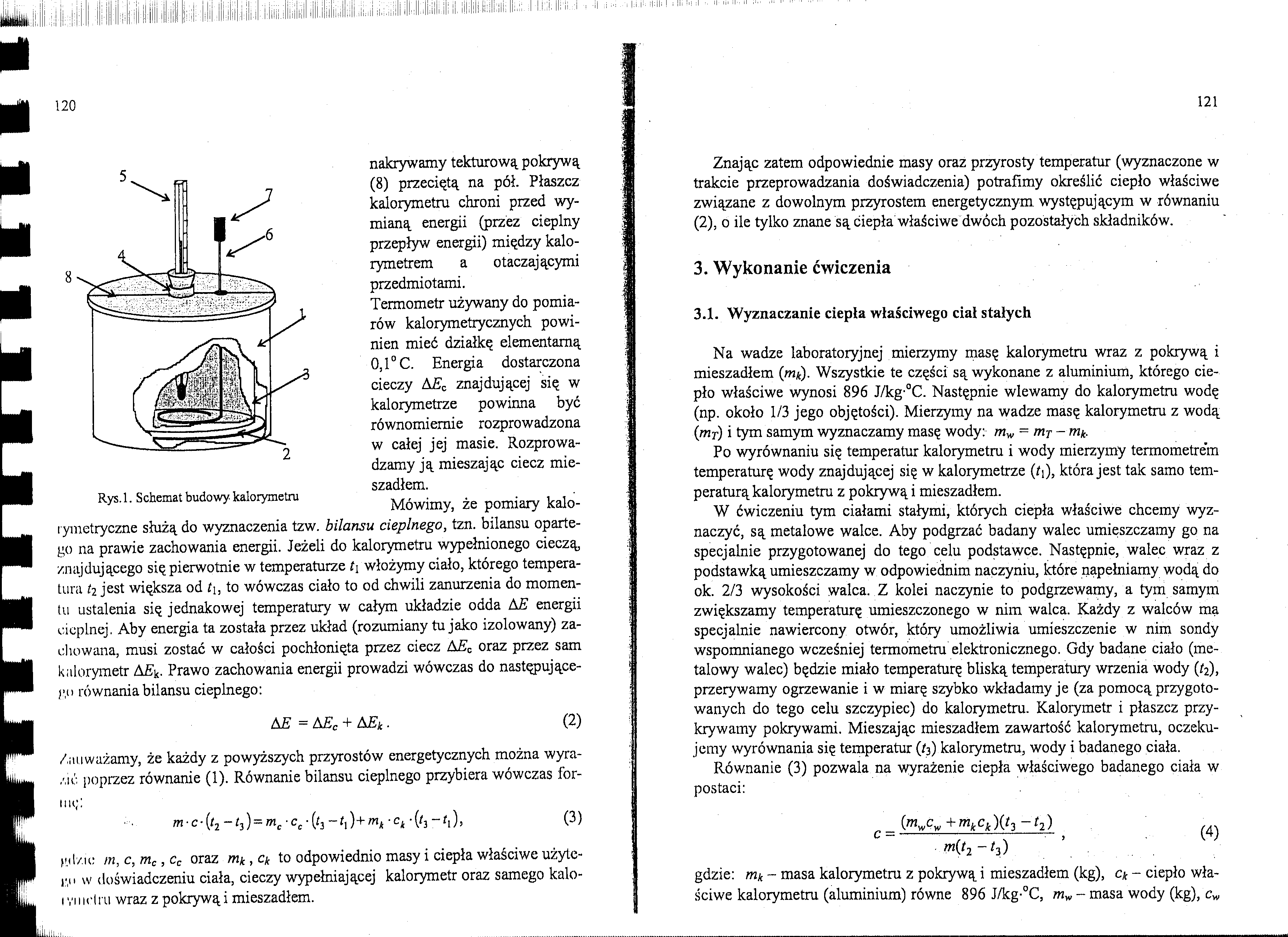
nakrywamy tekturową pokrywą (8) przeciętą na pół. Płaszcz kalorymetru chroni przed wymianą energii (przez cieplny przepływ energii) między kalo-rymetrem a otaczającymi przedmiotami.
Termometr używany do pomiarów kalorymetrycznych powinien mieć działkę elementarną 0,1° C. Energia dostarczona cieczy A£c znajdującej się w kalorymetrze powinna być równomiernie rozprowadzona w całej jej masie. Rozprowadzamy ją mieszając ciecz mie-
„ , „ , , . , , szadłem.
Rys. 1. Schemat budowy-kalorymetru . . . , , •
Mówimy, ze pomiary kalorymetryczne służą do wyznaczenia tzw. bilansu cieplnego, tzn. bilansu opartego na prawie zachowania energii. Jeżeli do kalorymetru wypełnionego cieczą znajdującego się pierwotnie w temperaturze t\ włożymy ciało, którego temperatura h jest większa od t\, to wówczas ciało to od chwili zanurzenia do momentu ustalenia się jednakowej temperatury w całym układzie odda AE energii cieplnej. Aby energia ta została przez układ (rozumiany tu jako izolowany) zachowana, musi zostać w całości pochłonięta przez ciecz AEc oraz przez sam kalorymetr APrawo zachowania energii prowadzi wówczas do następującego równania bilansu cieplnego:
ŁE = AEC + AEk. (2)
Zauważamy, że każdy z powyższych przyrostów energetycznych można wyrazić poprzez równanie (1). Równanie bilansu cieplnego przybiera wówczas formę:
gdzie m,c,mc,cc oraz mk , ck to odpowiednio masy i ciepła właściwe użytego w doświadczeniu ciała, cieczy wypełniającej kalorymetr oraz samego kalo-i yinolru wraz z pokrywą i mieszadłem.
Znając zatem odpowiednie masy oraz przyrosty temperatur (wyznaczone w trakcie przeprowadzania doświadczenia) potrafimy określić ciepło właściwe związane z dowolnym przyrostem energetycznym występującym w równaniu (2), o ile tylko znane są ciepła właściwe dwóch pozostałych składników.
3. Wykonanie ćwiczenia
3.1. Wyznaczanie ciepła właściwego ciał stałych
Na wadze laboratoryjnej mierzymy masę kalorymetru wraz z pokrywą i mieszadłem (m*). Wszystkie te części są wykonane z aluminium, którego ciepło właściwe wynosi 896 J/kg-°C. Następnie wlewamy do kalorymetru wodę (np. około 1/3 jego objętości). Mierzymy na wadze masę kalorymetru z wodą (mT) i tym samym wyznaczamy masę wody: mw = mT- m*>
Po wyrównaniu się temperatur kalorymetru i wody mierzymy termometrem temperaturę wody znajdującej się w kalorymetrze (t[), która jest tak samo temperaturą kalorymetru z pokrywą i mieszadłem.
W ćwiczeniu tym ciałami stałymi, których ciepła właściwe chcemy wyznaczyć, są metalowe walce. Aby podgrzać badany walec umieszczamy go na specjalnie przygotowanej do tego celu podstawce. Następnie, walec wraz z podstawką umieszczamy w odpowiednim naczyniu, które napełniamy wodą do ok. 2/3 wysokości walca. Z kolei naczynie to podgrzewamy, a tym samym zwiększamy temperaturę umieszczonego w nim walca. Każdy z walców mą specjalnie nawiercony otwór, który umożliwia umieszczenie w nim sondy wspomnianego wcześniej termometru elektronicznego. Gdy badane ciało (metalowy walec) będzie miało temperaturę bliską temperatury wrzenia wody (t2), przerywamy ogrzewanie i w miarę szybko wkładamy je (za pomocą przygotowanych do tego celu szczypiec) do kalorymetru. Kalorymetr i płaszcz przykrywamy pokrywami. Mieszając mieszadłem zawartość kalorymetru, oczekujemy wyrównania się temperatur ((j) kalorymetru, wody i badanego ciała.
Równanie (3) pozwala na wyrażenie ciepła właściwego badanego ciała w postaci:
(4)
(mwcw+mkck)(t3 -t2)
gdzie: mk - masa kalorymetru z pokrywą i mieszadłem (kg), c* - ciepło właściwe kalorymetru (aluminium) równe 896 J/kg-°C, mw - masa wody (kg), cw
Wyszukiwarka
Podobne podstrony:
skanuj0061 120 120 Rys.l. Schemat budowy kalorymetru nakrywamy tekturową pokrywą (8) przeciętą na pó
skanuj0024 (120) i 208 Rozdział 6. Język i mass media: znaczące płaszczyzny komunikacji dzo wielu ar
16539 skanuj0024 (120) i 208 Rozdział 6. Język i mass media: znaczące płaszczyzny komunikacji dzo wi
20 PISMO PG musiałem tę bańkę przeciąć na pól, żeby zmierzyć jej wielkość w środku.
Utargi u monopolu. W monopolu utarg krańcowy dzieli utarg przeciętny na pół l 0 Monopol ma typo
Kotylion słowny(1) albo znane po wiedzonka, składające się z dwóch części. Kartki przecinacie na pól
skanuj0112 (6) 120 120 1. Na czym polega wyższość akcyjnej formy własności nad
skanuj0114 3 120 Rozdział 8. przetworników sił. Konstrukcja tych przetworników polega na umieszczeni
skanuj0002 — 120 — ORGANIZACJE TURYSTYCZNE NA ŚWIECIE9.3. Światowa Rada Podróży i
70024 skanuj0112 (6) 120 120 1. Na czym polega wyższość akcyjnej formy własności n
IMAG0998 3,5 cm Zadanie 24 e) 120 j on ® 20 y> okręgU opisanego na trójkącie leży ^„kde przecięci
skanuj0014 (120) PRZY KŁADY: ( O -l , -i C Q-x _ c _ r i ,~j _ _
więcej podobnych podstron