skanuj0061
120
120
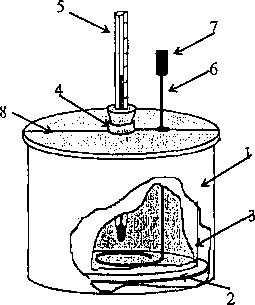
Rys.l. Schemat budowy kalorymetru
nakrywamy tekturową pokrywą (8) przeciętą na pół. Płaszcz kalorymetru chroni przed wymianą energii (przez cieplny przepływ energii) między kalo-rymetrem a otaczającymi przedmiotami.
Termometr używany do pomiarów kalorymetrycznych powinien mieć działkę elementarną 0,1° C. Energia dostarczona cieczy AEz znajdującej się w kalorymetrze powinna być równomiernie rozprowadzona w całej jej masie. Rozprowadzamy ją mieszając ciecz mieszadłem.
Mówimy, że pomiary kalorymetryczne służą do wyznaczenia tzw. bilansu cieplnego, tzn. bilansu opartego na prawie zachowania energii. Jeżeli do kalorymetru wypełnionego cieczą znajdującego się pierwotnie w temperaturze fj'włożymy ciało, którego temperatura h jest większa od t\, to wówczas ciało to od chwili zanurzenia do momentu ustalenia się jednakowej temperatury w całym układzie odda AE energii cieplnej. Aby energia ta została przez układ (rozumiany tu jako izolowany) zachowana, musi zostać w całości pochłonięta przez ciecz AEc oraz przez sam kalorymetr AĄ- Prawo zachowania energii prowadzi wówczas do następującego równania bilansu cieplnego:
AE = AEC + AEk. (2)
Zauważamy, że każdy z powyższych przyrostów energetycznych można wyrażać poprzez równanie (1). Równanie bilansu cieplnego przybiera wówczas formę:
m-c-(f2 -r3) = mc cc-(f3 -ti)+mt-ck -(*3 -h)> (3)
gdzie m, c, mc, cc oraz m*, Ck to odpowiednio masy i ciepła właściwe użytego w doświadczeniu ciała, cieczy wypełniającej kalorymetr oraz samego kalo-i Yindm wraz z pokrywą i mieszadłem.
Znając zatem odpowiednie masy oraz przyrosty temperatur (wyznaczone w trakcie przeprowadzania doświadczenia) potrafimy określić ciepło właściwe związane z dowolnym przyrostem energetycznym występującym w równaniu (2), o ile tylko znane są ciepła właściwe dwóch pozostałych składników.
3. Wykonanie ćwiczenia
3.1. Wyznaczanie ciepła właściwego ciał stałych
Na wadze laboratoryjnej mierzymy masę kalorymetru wraz z pokrywą i mieszadłem (wi*). Wszystkie te części są wykonane z aluminium, którego ciepło właściwe wynosi 896 J/kg-°C. Następnie wlewamy do kalorymetru wodę (np. około 1/3 jego objętości). Mierzymy na wadze masę kalorymetru z wodą (mT) i tym samym wyznaczamy masę wody: mw = mT- m*.
Po wyrównaniu się temperatur kalorymetru i wody mierzymy termometrem temperaturę wody znajdującej się w kalorymetrze (/i), która jest tak samo temperaturą kalorymetru z pokrywą i mieszadłem.
W ćwiczeniu tym ciałami stałymi, których ciepła właściwe chcemy wyznaczyć, są metalowe walce. Aby podgrzać badany walec umieszczamy go na specjalnie przygotowanej do tego celu podstawce. Następnie, walec wraz z podstawką umieszczamy w odpowiednim naczyniu, które napełniamy wodą do ok. 2/3 wysokości walca. Z kolei naczynie to podgrzewamy, a tym samym zwiększamy temperaturę umieszczonego w nim walca. Każdy z walców mą specjalnie nawiercony otwór, który umożliwia umieszczenie w nim sondy wspomnianego wcześniej termometru elektronicznego. Gdy badane ciało (metalowy walec) będzie miało temperaturę bliską temperatury wrzenia wody (t2), przerywamy ogrzewanie i w miarę szybko wkładamy je (za pomocą przygotowanych do tego celu szczypiec) do kalorymetru. Kalorymetr i płaszcz przykrywamy pokrywami. Mieszając mieszadłem zawartość kalorymetru, oczekujemy wyrównania się temperatur (^ kalorymetru, wody i badanego ciała.
Równanie (3) pozwala na wyrażenie ciepła właściwego badanego ciała w postaci:
(4)
(mwęw+mkck)(l3 -t2)
gdzie: m* - masa kalorymetru z pokrywą i mieszadłem (kg), c* - ciepło właściwe kalorymetru (aluminium) równe 896 J/kg-°C, mw - masa wody (kg), cw
Wyszukiwarka
Podobne podstrony:
skanuj0061 120 120 nakrywamy tekturową pokrywą (8) przeciętą na pół. Płaszcz kalorymetru chroni
skanuj0013 Rys. 8.5. Schemat budowy niektórych roś!::; sadownicz; wiśni, b -
Rys. 4. Schemat budowy dwuobwodowego głównego zaworu hamulcowego: a) położenie odhamowania, b) hamow
a) b) Rys. 6. Schemat budowy sprężarki jednocylindrowej chłodzonej powietrzem: a) wygląd zewnętrzny,
Rys. 8. Schemat budowy regulatora ciśnienia: a) wygląd zewnętrzny, b) budowa, 1-śruba regulacyjna,
Badanie elementów układów automatycznego sterowania Rys. 5. Schemat budowy przekaźnika czasowego
SDC12992 /, juwuuouyu) l siiiiiitaiui aAUAunjini Rys. 7.1. Schemat budowy i działania silnika wysok
44791 skanuj0002 777777777777777 b) 777777777777777 Rys. 2-6. Schematy płyt Schenriqt a Schemat b l
Włóknoi Elektrony Rys.2. Schemat budowy działa elektronowego. Następnie elektrony są rozpędzane
Włóknoi Elektrony Rys.2. Schemat budowy działa elektronowego. Następnie elektrony są rozpędzane
Rys. 1. Schemat ręcznego kalorymetru Junkersa. 1 - kalorymetr Junkersa; 2 - dopływ gazu z sieci gazo
ZAŁĄCZNIKI: Energia a środowisko MATERIAŁY DLA NAUCZYCIELI Rys. 3. Schemat budowy turbiny
DSC00397 (3) Tpl(4.. (4.5 Rys.4.6. Schemat budowy młota wahadłowego typu Charpy, gdzie: I 1 - korpus
a) c) Rys. 8. Schemat budowy i działania docisku rakla: 1 - rakiel, 2 - listwa podpierająca, 3 - pod
więcej podobnych podstron