0100

dalej
giukozo-1-fosforan -f fruktoza -> sacharoza -f P1
l)
kcal
mol
w sumie otrzymamy
kcal
mol
ATP + glukoza - fruktoza sacharoza 4- ADP 4- P1
Tak więc reakcja syntezy sacharozy z glukozy i fruktozy może zachodzie w sprzężeniu jej z reakcją egzoergiczną, kosztem entalpii swobodnej tej ostatniej.
4.5. Energia swobodna i entalpia swobodna gazu doskonałego
Znajomość energii swobodnej i entalpii swobodnej gazu doskonałego jesi punktem wyjścia dla zrozumienia wielu procesów fizycznych i chemicznych, a zatem także biofizycznych. Ograniczymy się do procesów izotermicznych, takie bowiem zachodzą prawie wyłącznic w organizmach żywych.
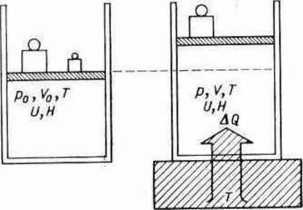
Ryc. 4.5. Izotermiczne rozprężenie gazu. Ciepło pobrane A Q jest równe pracy wykonanej W.
Podczas izotermicznego rozprężenia n moli gazu o temperaturze T ze stanu puV0 do stanu p. V (ryc. 4.5) entropia gazu wzrośnie o
AS = = n ż? In = —nR In — dla T= const 4.25
T • V0 p0
Wzór 4.25 można otrzymać następująco. Ciepło Ag pobrane przez układ zużywa się na wykonanie pracy — W, przy czym
V
f V P
W=— lpdP = -nRTln-= «7?7'ln—
J Po P«
w przekształceniach wykorzystano zależność pV = paV0 = nRT. Ponieważ — W/= AQ, otrzymujemy zależność 4.25.
Żeby otrzymać zmianę energii swobodnej i entalpii swobodnej, zwróćmy uwagę, że w procesie izotermicznym AU — 0 oraz AH = 0. Wobec tego zgodnie z 4.18 i 4.22
107
Symbol P grupa fosforanowa.
Wyszukiwarka
Podobne podstrony:
148 3 i dalej: glukozo-1 -fosforan ♦ fruktoza -* sacharoza ♦ P. AG^ = 0: P - reszta fosforanowa W su
DSCF7421 GLIKOLIZA sacharoza fruktoza SKROBIA glukozo* 6 - fosforan glukoza glukozo -1- fosforan fru
P1060451 Kontrola glikolizy I. Heksokinaza wysokie stężenie giukozo-ó-fosforanu hamuje
chemia zywnosci�1 Cukry proste i oligosacharydy 21 Odczynniki i sprzęt • glukoza,
P1060421 Etap I cd.Fosforylacja fruktozo-6-fosforanu do fruktozo-1,6-difosforanu CH2OTO3 OH/ OH O CH
DSCF7577 Gujkoneogeneza * Mleczan Glukozaii f GlukozoG-fosforan Fruktozo-6-losforan t
skanowanie0010 (29) 2014-01-13Moc wiązania wodorowego • Słabe wiązania wodorowe i-
Img00260 264 Si O (energia wiązania 89,3 kcal/mol). Własności polimeru zależą od charakteru rodnika
DSC00908 Metabolizm fruktozy w wątrobie Szlak fruktozo-1 -fosforanowy Fruktoza AMlfl
Glukoza 1i Glukozo-6-fosforan 2 <s7 Fruktozo-6-fosforanV Fruktozo-1
80 2 3 gIukozo-6-fosforan + 6 NADP*-> 2 glukozo-S-fosforan + 3 aldehyd D-fosfog!icerynowy * C02+
Image(3760) Konwersja glukozy do fruktozy taniego zamiennika sacharozyKonwersja chemiczna • &n
więcej podobnych podstron