100B66

OioXXuy
t
W
Egzamin -termin II Chemia + Bioechnologia
ZtB>fi CZZMCko, grup*
|
li_1 |
|2 |3 M | |
I5 1 |
\6 1 |
I7 1 |
It |
I9 |
o m" |
|
1 1 |
[III |
! 1 |
I 1 |
1 1 |
1 I 1 |
? Fr
Jo* ł
Al o
U3)
jj f Stwterdzooo, te katalizowana reakcja nitrowania loloeou do monom tropoebodaych-o , -p, -m przebiega jako reakcja
pierwszego rzędu. Po 20/ninutacfa zużyte zastało 40% substrafu. W produktach stwierdzono następująoe Icśd: -o \y (70%). -p (20%), -ta (10%). Obliczyć stale szybkości reakcji otrzymywania trzech pochodnych.
Zi&3 gg)
^ j
Kinetyka reakcji z fezą stałą . Podaj 3 możliwo mechanizmy i krzywe kinetyczne w reakcjach korozji metali. \tf | Wyprowadź równanie idncl/czue zwane prawem parabolicznym. V
aidiaoiK rubstratu. \ sakcjl otrzy
c£0$~- Teonjb^JŁ.
I krzyw* kinetyczne w
Tcoru?( 'IS
r Stwśerdzona. ź* jednofazowy rozkład ozonu pod umiarkowanym ciśnlenJćm jest reakcją drugiego rzędu, hamowaną [ przez dea. Pnypazzczaloy mechanizm tej reakcji jest następują^
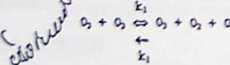
0)
V
l5°)
O * o* -* 20, (2).
Wyprowadź dla warunków stacjonarnych wyraźnie na szybkość rozkładu ozonu zgodnie z danymi doświadczalnymi. Zad, 4 ffp) (Blotecbooloriil
Mając do dyspozycji schemat przriść elektronowych w cząsteczce wśeloalomowej:
* 1
Zad. 5 (6o\
■£o.a .9 ■
■ | J Dwucząsteczkowa reakcja w( roztworze wodnym: A ♦ B -» C ♦ D jest reakcją
0 <b ^fcirgo rzędu, której staia szybkości reakcji w temperaturze 40* £ wynoei J.72 -10 ^ mol"'dmł i *' j w
1 "j / ii le®p6raturze 50* C jest 3 razy wśęksasi Stężenia początkowe C**“ 0.1 mol/dm* i Cm *"0.1 md/dn^Oszaeować l wartość entalpii swobodne) aktywacji tej reakcji wtemp. 45* C
, n*.f. Prt/ ^ Te^rtoj .
Wyprowadź wyraźenJa Ncrnsta dla prostego procesu elektrody pierwszego rodzaju;
Me* ♦ e -+Me |
}>%
7P& ■
.ąlĄĄ 7M
( h*<£*
*+ łt/pl* Mrt*
Zaproponuj ogniwa galwaniczne w których biegną następujące reakcje chemiczne oraz podaj wyrażenia określające potencjały elektrod i SCMegolwi^. / \
3f«, ♦ 2Hg

. 3H*ą> ♦ A»jO)(ł
ZoO,
2Aa
3*
• 3HjO
cZctcs . <2.
Oblicz silę elektromotoryczną ogni wa stężeniowego bez przenoszenia;
>
w temp. 29Z K. średni jonowy współczynnik aktywności roztworu KO o stężeniu 0.01 mol/kg wynosi jtm 0.643 a ' potencjały standardowe elektrod wynoszą E*»c«A*ao* - 0.222 V oraz E*.*** - -2.93 V odpowiednio dla elektrody chlorcsrebrowej i potasowej metalicznej pierwszego rodzaju. ,
'AglAgClM I KCI wq lK 0.01 mol/kg
0S
Kov,J KO M | AgOw 1 Ag * 0.001 m/kg Sb

Zad 9 (SpI
, (W;

va
M.
V.
k*
V
Oł*ł*'-
wyprowadź car.ępcjąpc wyrażenie na wydąlocóć kwantową reakcji;
V ♦ 8 -f produkty ę - 1
HŁ4JMKMM ^ feeria 4tf-
Reakcje następcze - przykłady, wyprowadzenie równania kinetycznego, wykres zmian stężenia reagentów w czasie.
<&*Ct •
iiy elektromotorycznej
®*C
dniać? Poc
f-
^Zaproponuj pian pomiarów w celu wyznaczenia standardowej siły elektromotorycznej ogiwa oraz średniego \ współczynnika aktywności etanolowego roztworu HO w temperaturze 30 *C
M
4*
r\ ' takiego ogniwa.
T
***L*d' fet^rrot Zace.n. U
Podaj zależność siły elektromotorycznej od ciśnienia; w Jakich ogniwach należy to uwzględniać? Podaj przykład (pUtu*
Wyszukiwarka
Podobne podstrony:
scan007 (2) Egzamin -termin I Biotechnologia-Chemia Imię i nazwisko, grupa I» 1 I2 1 i3 1 4 I5 1 6
Egzamin -termin 1 Biotechnologia-Chemia Imię i nazwisko, grupa I1 1 I2 13 4 5 I6 1 I7
tb22010stpie 27 09.2010 Elektronika III rok. Egzamin - termin II (część B) Imi Pu Systemy radiokomun
termin 2 10 B t[U Matematyka - egzamin termin II 18 lutego 2010, czas pisania: 90 min. Imię i Nazwis
100B65 Egzamin -termin I Biotechnologia - Chemia Ini( I nazwisko, grupa I1 1 li_ 13 1.4 I5 I6
Techniki Obrazowania Medycznego 02.02.201 lr. (egzamin - termin II): 1. Jakie
Dziawgo; Działania na macierzach, podstawpwe typy macierzy 1 so / / rsli:i‘i i llnlowii, l:niin>i
i f TI ii l3 i H Ul 1 *Wi ! fi lii. 1. jjj " ł * 1 i < li i n i 1 *■ I 1 [4aU ,-•! f II i
Fizyka 2, termin II, zestaw A,0 06 2010 cz 1 Egzamin z fizyki II - termin II, zestaw A 30.06.2010 I.
Fizyka 2, termin II, zestaw A,0 06 2010 cz 2 Egzamin z fizyki II - termin II, zestaw A 30.06.2010 .a
Fizyka 2, termin I, zestaw A,# 06 2010 cz 2 Egzamin z fizyki II - termin I, zestaw B 23.06.2010 7. N
geodezja Egzamin z geodezji II - Studium Zaoczne - 14.06.2008 r. Termin 1/1 L- 2.
skanuj00261 Egzamin -termin I Chemia + Biotechnologia Imię i nazwisko,
Egzamin 01 02 (termin II) Egzamin poprawkowy z matematyki, 2 sem. WBWilŚ, r. 2001/2002 Nazwisko i
więcej podobnych podstron