208 2
pH w przybliżeniu wyaoii 7. dlatego przyjęto również określenie potencjału standardowego oksydorolultcyjnego # dla pH ■ 7. Wykazano. że:
£?■£•-0.42 V (8.9)
to znac/y. źc standardowy potencjał oksydoredukcyjny €* (przy pH = 7) jest mniejszy od standardowego potencjału oksydoredukcyjnego £° (przy pH « 0).
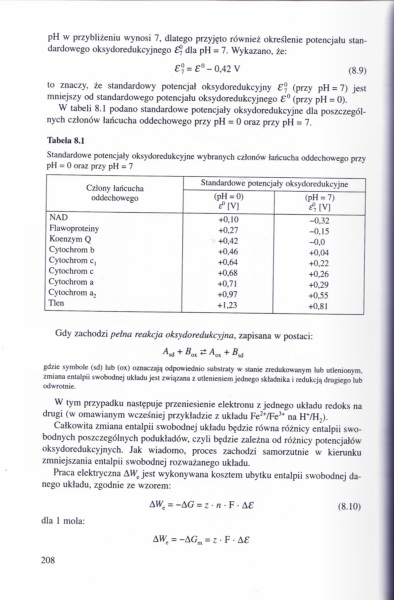
W tabeli 8.1 podano standardowe potencjały oksydoredukcyjne dla poszczególnych członów laócucha oddechowego przy pH * 0 oraz przy pH ■ 7.
Tabela 8.1
Standardowe potcncjiły oktydorcdukcyjnc wybranych członów łaiktarłu oddechowego przy pH • 0 oraz przy płl » 7
|
Człony łańcucha oddechowego |
Standardowe potencjały* oksydoredukcyjne | |
|
<pH • 0) <°|V| |
(pH - 7) | |
|
NAD |
♦0.10 |
-0.32 |
|
Hawoproteiny |
♦0.27 |
-O.I5 |
|
Koenzym Q |
♦0.42 |
-0.0 |
|
Cyiochrom b |
♦0.46 |
♦O.tM |
|
Cytochrom c, |
♦0.64 |
♦0.22 |
|
Cytochrucn c |
♦0.68 |
♦0.26 |
|
Cytochrom a |
♦0.71 |
♦0.29 |
|
Cytochrom a. |
♦0.97 |
♦0.55 |
|
Tkn |
♦ 1.23 |
♦0.81 |
Gdy zachodzi ptina nr akr ja oksydortdukcyjna, zapisana w postaci:
gdne łymh* («d) fab Im) untKuęą odpowiednio waburaly w Ain* ntótśummym htb mkmomm. inuma enutęm *wę*odiK) układu jol /»ią/jna i i*kmouc*n jrdnrgo tktajniki i redukcją drupego lub odwrotnie
W tym przypadku następuje przeniesienie elektronu z jednego układu redoks na drugi (w omawianym wcześniej przykładzie z układu Fe2*/Fc^ na HVH2).
Całkowita zmiana entalpii swobodnej układu będzie równa różnicy entalpii swobodnych poszczególnych podukładów. czyli będzie zależna od różnicy potencjałów oksydoredukcyjnych. Jak wiadomo, proces zachodzi samorzutnie w kierunku zmniejszania entalpii sw'ot>odncj rozważanego układu.
Praca elektryczna &Wt jest wykonywana kosztem ubytku entalpii swobodnej danego układu, zgodnie ze wzorem:
AWc - -AG =* znFAC (8.10)
dla I mola:
AW, * -AG. - z • F A£
208
Wyszukiwarka
Podobne podstrony:
img283 Dlatego należałoby raczej określić równanie regresji wyższego stopnia, a następnie, po zbadan
skanuj0030 (154) Przyjęcie demograficznego określenia urbanizacji nie prowadzi wcale do jakiegoś z
skanuj0376 (2) wytwórca w katalogach. Sprzęgła te są również określane jako sprężyste palcowe. W cza
terminu hermetyzacja spotyka się również określenie enkapsulacja. Podobnie jak w innych językach
G00039 jąca surowiec tkaniny została przyjęta jako określenie ubioru niezależnie od rodzaju włókna u
zasobów, kierunek rozwoju ( ekstensywny lub intensywny). Możemy również określić czy dany podmiot ro
CCF20121215�36 52 czyli najmniej znaczący bit (rys. 2.6). Spotyka się również określenia: bit najsta
Moc odbiornika można również określić z zależności (1.6) na podstawie pomiarów napięcia i prądu. 2.
C19 (4) W nomenklaturze światowej dla mięsa normalnego przyjęło się określanie go skrótem RFN (red-f
więcej podobnych podstron