208 4
r ruMC/ STflUłCTURAl NC
r ruMC/ STflUłCTURAl NC
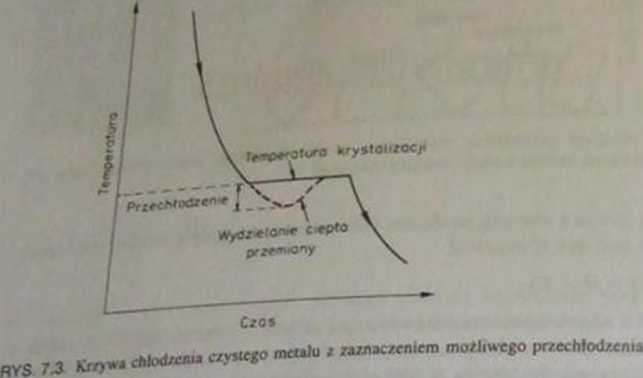
. przykładem obliczania siły pędnej dla zachodzących w materiałach iw„mlnVch jest krystalizacja. Rozważania przeprowadzono dla krys-wlsię lodu). W temperaturze topnienia (r, = 273 K pod m 1013 hPa; w oda i lód znajdują się w stanie równowagi, a zatem entalpie Cl otodne wody i lodu są takie same; AC = 0. Ponieważ entalpie swobodne wody (CS) i lodu (&) w temperaturze Tt są określone równaniami:
(r-tr-TS*
G1 = H1 — TS1
zatem w temperaturze T.
AG = AH- T,AS = 0 przy czym
AH = H* - H' i AS^r-S1
a stąd
(7.2)
AS = ^ 1
W tym przypadku AH jest ciepłem topnienia. W celu stopienia lodu należy dostarczyć ciepła. Entropia jest miarą nieporządku, dlatego z równania (7.2) wynika, że większy nieporządek w przestrzennym rozmieszczeniu cząsteczek panuje w wodzie niż w lodzie (uporządkowanie atomów w cieczy jest mniejsze ni/ w kiysziąle). Podczas topnienia lód pochłania ciepło, a tworząca się. woda ma wyższą
chłodzona do temperatury T < T, wykazuje tendencję do zamarza-*°°* „ tVm procesem zmianę entalpii swobodnej określa równanie
W*** Z 3
- ,C - AW - rAS r?-3)
ą// i AS sa niezależne od temperatury (takie założenie jest poprawne % .vin‘UJ,C,ju/>ch przcchłodzeń; A7 I, - T). z równań (7.2) i (7.3) otrzymujemy
^ AC*^ir'-r) (7.4)
. yK^ niC wykorzystajmy powyższe rozważania do wyznaczenia sity pędnej 43 zcia przechlodzoncj o I K wody (AT= 1 Ki Dla wody. okreilone v '^‘'"kalorymetrycznym, ciepło topmema AH = 334 kJ kg dlatego z rów-^i*#**' 0irzy.nnjcin>’ AC ~ (334 1,/273 = 1:22 u kg 1 (lub 22 J mol '). £•* 1 ■ lodu o 1 K PowoduJC wylwor/cnic takiej samej sity pędnej do topnienia
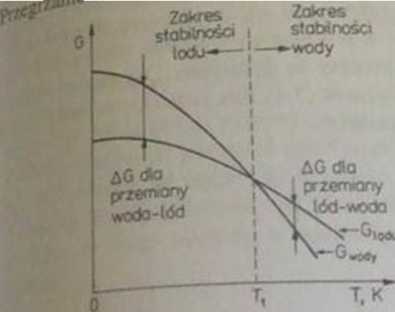
74 Zależno^ entalpii swobodnej wody i lodu od temperatur} Powyżej temperatury T, *** 0U> C-^*WiCCłUbilnąpOSlaC'4H,0jCSlWOda Pon,iCJ stabilną postacią H;0 jest lód.
gdy/ 6*-o >
Zależność entalpii swobodnej wody i lodu od temperatury przedstaw tono na ^ 7.4. Z tego rysunku widać, że obszary' stabilności wody i lodu są określone położeniem krzywych entalpii swobodnej dla tych dwóch stanów skupienia H:0.
7.1.2. Zmiany struktury w stanie stałym
Wyżej opisane rozwiązanie można również zastosować do /.mian struktury- w stanie julym. na przykład do zmiany struktury krystalicznej RSC - RPC w żelazie lub RPC - HZ w tytanie. Wówczas
(7.5)
A H
AG = — (T,-T)
* r
209
Wyszukiwarka
Podobne podstrony:
3.2. Przykładowe obliczenia wartości ciśnień dla 4 punktu pomiarowego (podać wzory, podstawić wartoś
S6303030 430 HYDRAULIKA TECHNICZNA. PRZYKŁADY OBLICZEŃ jak np. dla koryta o żwirowym dnie i ściankac
226 227 13. Przykłady obliczeniowe13.1. Instalacje wodociągowe dla jednego mieszkania Należy zaproje
DSCF6667 288 Przykłady: (Obliczenia wg wzoru nr - nc — A + Ba) Współczynnik załamania na zmierzono p
PICT6504 Tcoretyc/nc liczebności obliczamy, mnożąc sumę „i-tego” wiersza przez sumę liczebności ..j-
208 Michał Sosnowski selektywnie wybranych rodzajów działalności. Przykładowo zastosowanie ulg i
Zdjęcie0202 (4) Skonsolidowanie wyników badania pozycji zakupowej firmy
Bilans materiałowy z reakcją c Czyli : Nc Ns11^=0, k = 1,2,..., 7=1 /=! W obliczeniach bilansowych
278 279 Mapy lopogranc/nc Pracochłonne obliczanie powierzchni za pomocą kalki milimetrowej może być
skanuj0027 (40) PRZYKŁAD OBLICZANIA PRZEKŁADNI ŁAŃCUCHOWEJ Materiałów dydaktycznych do ćwiczeń z PKM
Fizyka09 ZADANIA (PRZYKŁADY OBLICZENIOWE) Oblicz wartość oporu cieplnego R warstwy jednorodnej wykon
więcej podobnych podstron