CCF20091206�020

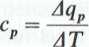
gdzie: Aqv i Aqp — ilość ciepła doprowadzonego do czynnika podczas przemiany zachodzącej odpowiednio w stałej objętości i pod stałym ciśnieniem,
AT — przyrost temperatury.
Podając definicję gazu doskonałego stwierdziliśmy, że jednym z warunków, jakie musi on spełniać, jest stałość ciepła właściwego. Tak więc dla gazu doskonałego stałe jest zarówno ciepło właściwe cv, jak i cp. Stały jest także ich iloraz
x = -^ (3.18)
Między wielkościami cp, cv i R zachodzi ponadto zależność
cp~cv = R (3.19)
Tablica 3.2
Ciepło właściwe i współczynnik x dla gazów doskonałych
|
Gaz |
cp |
Cv |
x = cp/cv |
|
5 B |
3 B |
5 | |
|
Jednoatomowy — np. He, Ar |
-= 1,67 | ||
|
2 M |
2 M |
3 | |
|
Dwuatomowy — np. 02, N2, |
7 B |
5 B |
7 5-W |
|
h2 |
2 M |
2 M | |
|
Wieloatomowy — np. CH4 |
9 B |
7 B |
9 |
|
-= 1,286 | |||
|
2 M |
2 M |
7 | |
|
B = 8,3147 kJ/(kmol -K)— uniwersalna stała gazowa M — masa cząsteczkowa, kg/kmol | |||
Ciepła właściwe cv i cp gazów doskonałych zależą tylko od ich masy cząsteczkowej i od budowy cząsteczki, a w tym przede wszystkim od liczby atomów w cząsteczce. Zależności określające wartości ciepła właściwego cv i cp oraz ich ilorazu x dla gazów doskonałych przedstawiono w tabl. 3.2.
Zgodnie z definicją ciepło właściwe gazu półdoskonałego jest funkcją temperatury, którą często określa się w przybliżeniu za pomocą wielomianu drugiego stopnia
cp = a + bt + ct2
(jil/lc: t — temperatura,
a, b i c — współczynniki zależne od rodzaju gazu.
Dla gazu półdoskonałego słuszna jest zależność (3.19).
( icpło właściwe gazów rzeczywistych zależy zarówno od tem-i" mlury, jak od ciśnienia. Dlatego podczas wykonywania dokładnych Mii zeń termodynamicznych należy korzystać z tablic, w których |Midano wartości ciepła właściwego odpowiadające różnym wartościom a mperatury i ciśnienia.
I 8. Energia wewnętrzna i entalpia gazów doskonałych, półdoskonałych i rzeczywistych
Jak wynika z prawa Joule’a i Thomsona, energia wewnętrzna gazu ii leży tylko od temperatury. Stwierdzenie to jest słuszne jednak wyłącznie dla gazów doskonałych i półdoskonałych. W przypadku gazu i /oczywistego energia wewnętrzna zależy zarówno od temperatury, jak ml ciśnienia.
Energia wewnętrzna właściwa gazu doskonałego jest opisana zależnością
u = cj (3.20)
Wzór (3.20) obowiązuje również dla gazu półdoskonałego, przy czym wielkość cv to w tym przypadku średnie ciepło właściwe w rozpali ywanym przedziale temperatury.
Entalpia gazów doskonałego i półdoskonałego, podobnie jak energia wewnętrzna, jest jedynie funkcją temperatury i nie zależy od ciśnienia, natomiast entalpia gazu rzeczywistego zależy również od ciśnienia.
Entalpię właściwą gazu doskonałego i półdoskonałego wyraża się wzorem
i = cpT (3.21)
z tym, że dla gazu doskonałego cp = const, a dla gazu półdoskonałego cp to średnie ciepło właściwe w określonym przedziale temperatury.
55
Wyszukiwarka
Podobne podstrony:
Całkowita ilość ciepła dostarczonego do odbiorców stanowiąca sumę energii doprowadzonej na potrzeby
Sprawność obiegu CarnotaVc ^ V Tg I I Ilość energii doprowadzonej do obiegu ze źródła
W pomieszczeniu, w którym znajduje się silnik , bez urządzenia, ilość ciepła przekazaną do powietrza
P1060673 resize Spawanie TIG prądem pulsującym zmniejsza ilość ciepła wprowadzaną do złącza, poprawi
Molowa pojemność cieplna, ciepło molowe ^Molowa pojemność jest to ilość ciepła potrzebna do ogrzania
DSCN4687 Zbiornik energii wewnętrznej Zd o stałej temperaturze Td stanowi źródło ciepła doprowadzane
Kopia image Ilość ciepła 0 potrzebną do ogrzania ciała o masie m tak, aby nastąpił przyrost jego tem
4-2011 PROBLEMY EKSPLOATACJI 215 ilość ciepła (przekazywaną do materiału), jaka zapewnia
ciepła doprowadzonego do obiegu parowego (<2d) 0 wyprowadzonego z kotła). Wynika stąd, że sprawno
16095 Zdjęcie0979 POJEMNOŚĆ CIEPLNA to ilość ciepła potrzebna do podniesienia temperatury substancji
wytworzenia 1 kg pary suchej jest to ilość ciepła potrzebna do podgrzania wody do stanu wrzenia, odp
Obliczenie ciepła doprowadzonego do obiegu izochorycznie Obieg Otto, punkt 3. p3=pmax
- ogromna ilość niewolników doprowadziła do uchwalenia dwóch ustaw
h) wydajność obiegu pompy jest to stosunek ciepła doprowadzanego do źródła ciepła o wyższej temperat
OBLICZANIE POTRZEBNEJ ILOŚCI POWIETRZA Ilość powietrza doprowadzana do kopalni powinna by: taka, aby
więcej podobnych podstron