CCF20110121�158
[J>Beata Ostrowska [£> Twoja matura -
8. a) 2Cu + 02 —» 2CuO; synteza
b) CuO + 2HC1 -> CuCl2 + H20; wymiana
c) CuCl2 + 2NaOH -» Cu(OH)2 i + 2 NaCl lub CuCl2 + 2KOH -> Cu(OH)2 i + 2 KC1; wymiana
d) Cu(OH)2 —> CuO + H20; analiza
e) CuO + C -> Cu + CO lub 2CuO + C -> 2Cu + C02; wymiana
9. równanie reakcji: 8A1 + 3Fe304 -> 9Fe + 4A1203 rodzaj reakcji: utleniania - redukcji
Spalająca się wstążka magnezowa dostarcza energii aktywującej tę reakcję.
10. 2MgNH4P04 -» Mg2P207 + 2NH3 + H20; typ reakcji: reakcja analizy
11. a) białe kryształy rozpuszczalne w wodzie
b) ciekły stan skupienia
c) stały stan skupienia
d) stały stan skupienia, przewodnictwo elektryczne
12. a) Bardzo trudno odróżnić dwa alkany na podstawie różnic we właściwościach chemicznych. Łatwiej
to zrobić na podstawie różnic we właściwościach fizycznych. Metan jest gazem, a n-heksan cieczą. Aby wykorzystać do odróżnienia reakcję chemiczną, należy masę jednego mola węglowodoru poddać spaleniu, a następnie określić skład ilościowy produktów spalania (masę wody i dwutlenku węgla). W przypadku heksanu masy produktów będą większe.
b) Br2 (aq.)- woda bromowa odbarwia się w reakcji z etynem (acetylenem); z etanem nie reaguje.
c) Wystarczy przeprowadzić reakcję chlorowania czy bromowania w obecności światła. Heksan przereaguje z chlorowcem, tworząc chloroheksan, zaś benzen nie będzie reagował w zwykłych warunkach. Wymaga użycia katalizatora, np. FeCl3.
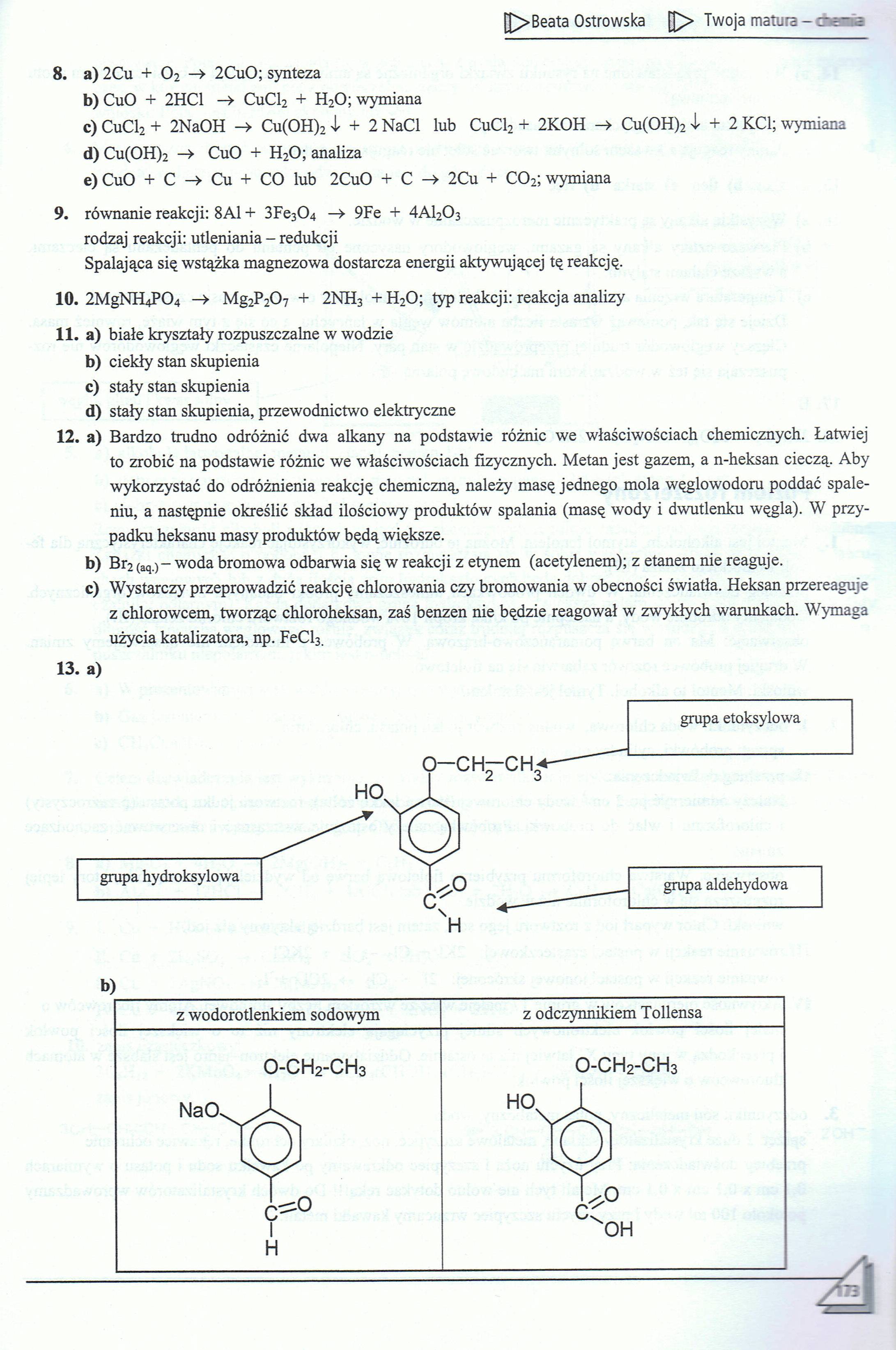
13. a)
|
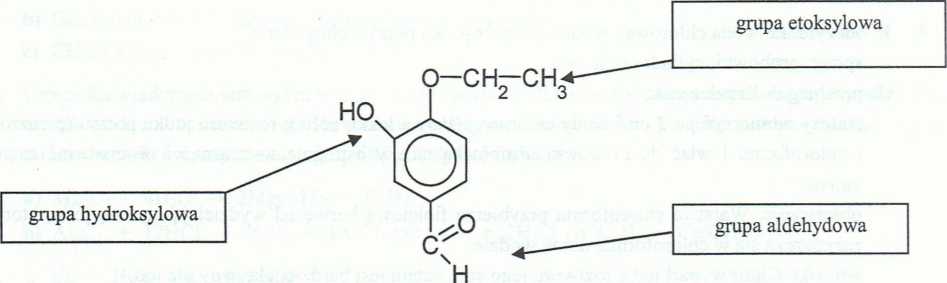
z wodorotlenkiem sodowym |
z odczynnikiem Tollensa |
|
O-CH2-CH3 |
O-CH2-CH3 |
|
Na°-VJL |
HOwk |
|
n |
O |
|
T <Uo |
Xo |
|
1 H |
OH |

Wyszukiwarka
Podobne podstrony:
CCF20110121�174 [J>Beata Ostrowska [£> Twoja matura - chemia P4O6 + 02 —> P4O10 H3PO4 + 3Na
CCF20110121�001 U> Beata Ostrowska [£> Twoja matura - ChemiaSpis
CCF20110121�003 D> Beata Ostrowska [£> Twoja matura - ChemiaBudowa atomu i promieniotwórczośćP
CCF20110121�005 B> Beata Ostrowska [£> Twoja matura - Chemia Pisać konfiguracje trwałych jonów
CCF20110121�013 l> Beata Ostrowska [£> Twoja matura - Chemia b) Jak zmienia się aktywność meta
CCF20110121�019 n> Beata Ostrowska [£> Twoja matura - ChemiaWiązania chemicznePoziom rozszerzo
CCF20110121�021 U> Beata Ostrowska [£> Twoja matura - Chemia Rozumieć istotę różnic w
CCF20110121�025 5. d> Beata Ostrowska [£> Twoja matura - Chemia Pisać pełne równania reakcji o
CCF20110121�027 [J> Beata Ostrowska [£> Twoja matura - Chemia b) Podaj wzory produktów organic
CCF20110121�029
CCF20110121�031 [[> Beata Ostrowska [£> Twoja matura - Chemia 4. Wiedząc, że metan jest gazem
CCF20110121�035 H> Beata Ostrowska
CCF20110121�041 O Beata Ostrowska [£> Twoja matura - Chemia 0-1 p. 0-1 p. c) Podaj nazwę
CCF20110121�051 n> Beata Ostrowska [£> Twoja matura - Chemia b) Której z substancji Li2C03 czy
CCF20110121�053
CCF20110121�055 K> Beata Ostrowska [£> Twoja matura - Chemia 11 . W tabeli podano rozpuszczaln
CCF20110121�059 Q> Beata Ostrowska
CCF20110121�063 u> Beata Ostrowska [£> Twoja matura - Chemia Stężenie procentowe i stężenie mo
CCF20110121�075 s> Beata Ostrowska [£> Twoja matura - Chemia a) Uporządkuj związki w kolejnośc
więcej podobnych podstron