Chemia rep12

- jako tzw. prawo stosunków stałych: w procesie tworzenia się związków chemicznych pierwiastki łączą się między sobą zawsze ściśle w określonych stosunkach masowych. Prawo to jest podstawą stosunków stechiometrycznych w reakcjach wykorzystywanych w obliczeniach chemicznych.
Prawo prostych stosunków objętościowych w reakcjach między gazami zostało sformułowane w 1809 r. przez Gay-Lussaca (1778-1 850): objętości reagujących ze sobą gazów i objętości gazowych produktów reakcji, w tych samych warunkach ciśnienia i temperatury, pozostają do siebie w stosunku niewielkich liczb całkowitych, np. 1:1,1:2, 2: 1 itd.
Prawo Avogadra. W celu wyjaśnienia empirycznego prawa Gay-Lussaca, włoski fizyk Avogadro (1776-1856) w 1811 r. podał ważną hipotezę dotyczącą właściwości gazów, zwaną dzisiaj prawem Avogadra: w równych objętościach różnych gazów w tych samych warunkach ciśnienia i temperatury znajdują się jednakowe liczby cząsteczek.
Z nazwiskiem Avogadra wiąże się również nazwana na jego cześć liczba, która jest współczynnikiem przeliczeniowym atomowych jednostek masy na gramy. Liczba Avogadra jest oznaczana symbolem NA Wyraża ona liczbę atomów węgla zawartą w 12 g, czyli molu nuklidu 12C.
Na = 6,02 • 1023 cząstek • mol'1 Objętości molowe substancji
Z fizyki wiemy, że masa każdej substancji jest proporcjonalna do jej objętości V i wyraża się wzorem
m = d • V
Współczynnik proporcjonalności między masą a objętością, oznaczany symbolem d, nazywa się gęstością i wyraża wzorem o wymiarze kg • m 3 lub g ■ cm ~3.
m
Jeżeli w równaniu d = — za m wstawiamy masę molową M, to po przekształceniu równania otrzymamy:
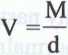
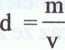
gdzie: V - objętość jednego mola substancji.
Jest to objętość molowa, którą oznaczamy symbolem VM. Podobnie jak masa molowa, objętość molowa jest wielkością charakterystyczną dla danej substancji. Objętość molową dowolnej substancji w określonej temperaturze (czyli objętość, jaką zajmuje 1 mol substancji) obliczamy, dzieląc masę molową M tej substancji przez jej gęstość d w danej temperaturze:

Za pomocą powyższego wzoru można obliczyć objętość molową substancji niezależnie od jej stanu skupienia: stałego, ciekłego czy gazowego. Przykładowo, objętość molowa wody ciekłej w temperaturze 4°C (277 K) wynosi:
ł8,02 g • mol'1 1 g • cm'3
= 18,02 cm3
• mol'1
a objętość molowa chlorku sodu (NaCl) w temperaturze 20°C (293 K.) wynosi (masa molowa NaCl równa jest 58,5 g • mol1, a gęstość d = 2,16 g • mol1):
= 27,08 cm3 • mol'1
58,5 g • mol"1 Vm = 2,16 g • cm'3 21
Wyszukiwarka
Podobne podstrony:
Prawo stosunków stałych (Proust’a) - stosunek ilości wagowych pierwiastków łączących się w dany
PTDC0050 84 Andrzej Porębski Jako wynik opisywanych dotychczas zjawisk i procesów jawi się częściowa
32 (88) CHEMIA I • ZAKRESY PODSTAWOWY I ROZSZERZONY a 20.* Proces tworzenia się kamienia kotłowego p
3 spodziewana absorpcję wiązki pompującej, która została zidentyfikowana jako proces tworzenia się
img151 b)stopień dysocjacji- to stosunek liczby moli cząsteczek danego związku chemicznego, które ul
Strona0003 Proces wtaczania sucstanca <związku chemicznego iud .Pierwiastka) w rancucn wewnetrzny
Slajd51 (60) Proces tworzenia się gwiazdy 1
Prot. Krzysztof Jemidniak STUW.fcl 2 349L5,ObróbkaSkrawaniem Część 4_ Proces tworzenie się
Cyklogeneza • proces tworzenia się i rozwoju niżów barycznych w atmosferze. Cyklon (niż baryczny) •
strona3 2 Gastrulacja - proces tworzenia się zespołów komórekzwanych listkami zarodkowymi (ektoderma
Na proces tworzenia się gleb wpływ mają rozmaite czynniki, przede wszystkim zaś rodzaj podłoża
Procesy tworzenia się gleb Procesy Wymywania= ełuwialny Przemywania= ilimeryzacji, lessiważu E- pozi
DSC07437 Proces tworzenia się gleby (wg J. Hanes) Stać mrtrzMC SMpiczB Sabstnt Pm—idu
więcej podobnych podstron