img102 2

2) enzymem a substratem. 3) enzymem a inhibitoiom, 4) przeciwciałem a antygenem lub haptenem, 5) komplementarnymi odcinkami kwasów nukleinowych, 6) kwasami nukleinowymi a białkami, 7) lektynami a cukrowcami. H) dopełniaczem a przeciw ciałami grupy lg(i. Warto zwrócić uwagę na to, że w przypadku każdej pary oddziałujących cząsteczek nie ma znaczenia, która z nich zostanie wybrana jako ligand. Dzięki temu za pomocą chromatografii powinowactwa, można zarówno wyizolować monoswoistc przeciwciała poliklonalne z surowicy odpornościowej, jeżeli dysponuje się czystym antygenem, jak i wyodrębnić antygen po przygotowaniu złoża, które zawiera unieruchomione odpowiednie monoswoiste przeciwciała.
Chromatografię powinowactwa przeprowadza się zwykle w' 2 etapach, tak więc pierwszy etap izolowania plazminogenu z osocza krwi z użyciem żelu Sepharose /c związaną lizyną polega na tym, że przez kolumnę zrównoważoną odpowiednim buforem przepuszcza się rozcieńczone tym buforem osocze. Dochodzi wówczas do specyficznej sorpcji przepływającego plazminogenu na unieruchomionej lizynie. IN» dokładnym odmyciu nicswoiście związanych białek i innych składników osoe/a w drugim etapie następuje rozszczepienie kompleksu lizyna plazminogen pod wpływem kwasu e-aminokapronowego, użytego do elucji plazminogenu. Jest t«* typowy przykład swoistej elucji substancji z sorbentu, ponieważ zarówno lizyna, jak i kwas *;-aminokapronowy są inhibitorami plazminy, powstałej przez aktywację plazminogenu, i wiążą się z tym samym miejscem w cząsteczce enzymu (rys. 4.20)
elucja
niezwiązanych
cząsteczek

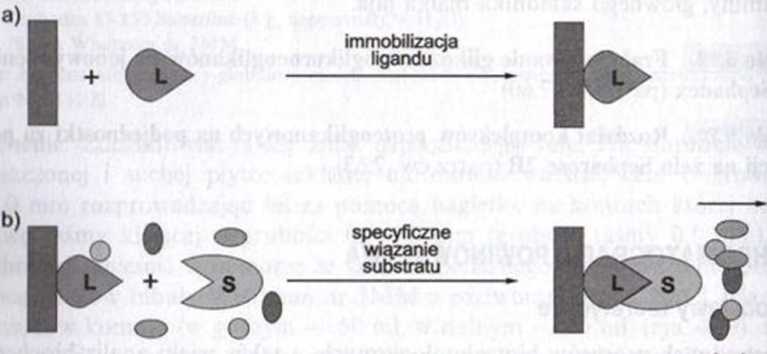
K>s. 4.20. Schemat procesu chromatografii powinowactwa (opracowanie autorów podrozdziału na podstawie materiałów promocyjnych Amcrsham Pharmacia Biotech). Wyróżniono 3 etapy charaktery-tyczne dla tej techniki: a) chemiczne związanie ligandu ze złożem (immobilizacja ligandu); b) spccyfic/n. wiązanie substratu do unieruchomionego ligandu oraz odmycie niespecyficznie zaadsorbowanych c/ąt teczek białkowych; c) clucja specyficznie związanego substratu.
Związki izolowane metodą chromatografii powinowactwu można cluować również w sposób niespecyficzny, za pomocą buforów o niskim lub wysokim pil (np. bufor octanowy, bufor węglanowy itp.), roztworów o dużej sile jonowej (2,5 M roztwór NaCl) czy związków rozrywających wiązania wodorowe (4 8 M roztwór mocznika, 6 M roztwór guanidyny). Zastosowanie zarówno specyficznych, jak i niespecyficznych eluentów pozwala uzyskać czysty preparat izolowanej substancji. W obu przypadkach w otrzymanych preparatach należy wymienić bufor w drodze dializy lub filtracji żelowej.
4.7.2. Złoża stosowane do chromatografii powinowactwa
Jako nośniki w chromatografii powinowactwa są stosowane złoża, które tradycyjnie wykorzystuje się do filtracji żelowej z tym, że przed użyciem konieczna jest odpowiednia ich aktywacja. Są to pochodne dekstranowe (Sephadex), agarozowe (Sepharose, Bio-Gel A) lub poliakrylamidowe (Bio-Gel P). Do aktywacji żeli dekstranowych i agarozowych powszechnie stosuje się reakcję z halogenocyjanami. Oprócz nośników, które można przygotować we własnym zakresie (Sephadex, Sepharose, Bio-Gel A), dostępne są również złoża już przystosowane do chemicznego wiązania ligandu, np. CNBr-activated-Sepharose 4B lub Affi-Gel 10. Rodzaj wiązania między ligandem i nośnikiem zależy zarówno od rodzaju substancji używanej jako ligand, jak i od nośnika. Ugrupowania karboimidowe, powstające podczas aktywacji żelu bromocyja-nem, reagują wyłącznie z grupami aminowymi przyłączanej substancji. Z aktywnym nośnikiem można następnie związać chemicznie wszystkie typy biopolimerów, tj. białka, kwasy nukleinowe oraz wiclocukrowce zawierające grupy aminowe. Ligandy białkowe wiążą się także za pomocą grup karboksylowych (Glu, Asp), hydroksylowych (Tyr, Ser, Thr) oraz sulfhydrylowych (Cys). Kwasy nukleinowe przyłącza się do nośnika za pośrednictwem reszt fosforanowych lub grup enolowych zasad azotowych, a cukrowce — przez grupy wodorotlenowe reszt cukrowych. W tabeli 4.11 podano rodzaje nośników oraz reagujące z nimi grupy funkcyjne ligandów.
Aktywność biosorbentu, szczególnie w przypadku wiązania małych ligandów, można znacznie podwyższyć, zwiększając do pewnych granic odległość miedzy cząsteczkami ligandu a powierzchnią nośnika. W ten sposób skutecznie eliminuje się efekt steryczny reszt cukrowych nośnika, sąsiadujących z ligandem, wywierany na specyficzne wiązanie izolowanej substancji. Jest to szczególnie istotne, gdy ligand to krótki peptyd, a substancja izolowana za jego pomocą jest znacznie większa i może mieć przestrzennie przysłonięte miejscem wiążące ligand. Stosuje się wówczas odpowiednio zmodyfikowane nośniki, np. AH- i CH-Sepharose. Mają one wbudowane kilkuwęglowe (najczęściej 6-atomowe) łańcuchy alifatyczne, nazywane grupami dystansowymi. Za ich pośrednictwem dochodzi do wiązania ligandu z nośnikiem.
W wielu przypadkach ten sam ligand bywa wykorzystany do izolowania licznej grupy substancji. Na przykład, po zastosowaniu złoża ze związanym białkiem A wyodrębnia się większość immunoglobulin klasy G, a na złożu ze związanym polinukleotydem poIi(U) można wyodrębnić mRNA.
149
Wyszukiwarka
Podobne podstrony:
040 8 Koniugacja antygenów lub haptenów z liposomami Liposomy wykazują In vivo własności adjuwa
P1010020 (3) Inhibitory pompy protonowej przeciwwskazania f nadwrażliwość lub nietolerancja J trymes
P1150209 (Medium) tynacja - reakcja wiązania przeciwciała z nierozpuszczalnym antygenem lub antygene
SNC03682 tu stacjonarnego przemieszczają się w przeciwnych kierunkach lub w tym samym kierunku z róż
immuno8 2011-04-13 PRZECIWCIAŁA ANTYGENY ab anty-HIV ag HIV ELISA j. WESTERN
e) sprawca ponownie popełnia przestępstwo, które skierowane jest przeciwko życiu lub zdrowiu bądź st
roz2 C c rienia przedmiotu 11.Jlicacwlę wymawia przeciętnie jedno lub < . &
nieprzytomności źrenice również są. wąskie, niekiedy wręcz przeciwnie szerokie lub nierówne, przy cz
więcej podobnych podstron