img138

soli prvriJsCnwia równanie:
tCl ♦ 11,0 » NaOlf * IICI
ih
iOj . -♦ K + N Oj So4 + 211:0 -♦ 2NaOH + H:SO,
i' 1
1+ 2H,0 -> 2K0H - HjS

« c) diurcid. d) monotircid .
ii U
Tm3 buforu o stężeniu 0,1 mola dodano I,ScmJ 11,0. .Jakie jest stężenie SfilŻęgo buforu (w molach/dm3), ilokrotnic rozcieńczono ten bufor i o ile jednostek zmieniło się pil tego buforu?
/sBtJyi bufor jest:
J
|<U f
ot. 5 x
vji :
10 X
. 15 x
20 x
łtj ^
H fe’go buforu zmieniło sic o:
'0,2 jednostki Sorensena 0,5 jednostek Sorensena w lijednostkę Sorensena
pH tego buforu nic zmieniło się .

dnlckowy w obecności kwasu siarkowego i nadmanganianu potasu, po lagodnsnt
Ii.
nim ulega reakcji, która •rożna przedstawić następująco:
... jCII(OH)COOII + 1/20, -s CO, 1 CII,CIIO + 11,0 CHjC 11(0 II) C O O M * 20, -> 2CO + CO, + 311,0 I
.1, mungauumclrycznic .
1>) jodomctrycznie.
c) analizą strąccniową - bezpośrednio .
d) analizą strąccniową - pośrednio .
c) prawidłowymi odpowiedziami są: b i c. prawidłowymi odpowiedziami są: c i d .
Związki kompleksowe zawdzięczają swoje istnienie wiązaniom: .1} jonowym . bl kowalencyjnym .
X koordynacyjnym .
d) molekularnym a .
W związku kompleksowym |Cu(KI Ij)i | (Oli); ligundem jest:
a) grupa OH '
b) Cu*:
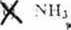
.1) l( 'niNll.i): |'"
/.auważalna zmiana barwy wskaźników pH uwarunkowana fizjologią procesu widzenia , obejmuje zakres: 1
a) 0,01 jednostki Sórensenn .
b) 0,1 jednostki Stirensena .
c) I jednostki Sorensena .
X 2 jednostek Sorensena .
Iizjologic/.ne pil knvi równe 7,42 jednostki Sorensena jest /.determinowane:
X stosunkiem stężenia jonów HCOj', do stężenia rozpuszczonego we krwi CO; (20: I).
b) stosunkiem stężenia kwasu II;COj,do stężenia jonów HCOj' we krwi (1:1).
1) stosunkiem stężenia rozpuszczonego we krwi CO; do rozpuszczonego Oi (5:1).
dl stosunkiem stężenia obecnych we krwi jonów HCOj', do iloczynu jonowego wody.
Wyszukiwarka
Podobne podstrony:
SL371946 3. }v 6 szkicuj reakcjami wykres E-pH wg równańth.IA o 9 •S ? 0 %ii 9 i/ł w42
skanuj0074 2 Rozwiązywanie równań 77 15. Rozwiąż równanie: a) 5*13 = 7 f)
SDC10116 1 Spalanie metanu przebiega zgodnie z równaniem: CMt ♦ 202 &nb
WYRAŻENIA A I O I & U16/ t odpowiednie równania: 2c ♦ 1 .d. J 4d» ] io
106 U Wdy równań liniowych [! lii 11 V
mech2 116 r 230 Rozwiązujemy równanie różniczkowe “ f$ ■= SlD f , i u =
mech2 116 r 230 Rozwiązujemy równanie różniczkowe “ f$ ■= SlD f , i u =
img138 (18) loli przedstawia ró>vnamc:»5 + HjO • NaOH « IICI O, —* K + NOj 04 + 2H,0 2NaOH + H:SO
DSC02266 (2) Posługując się wzorami ogólnymi soli, napisz równanie opisanej reakcji i na podstawie o
(207) równania: y (i - I r + y2 3
106 U Wdy równań liniowych lii 11 V
więcej podobnych podstron