img234 2

101
Tabela 5.2
|
Przykład zolu | |||||
|
Jądro zolu |
Fe(OH)3 |
Si02 |
As2S3 |
Agi |
Agi |
|
Jony adsorbowane |
Fe3ł, Cr3+ |
Si032“ |
HS |
Ag+ |
I |
|
Ładunek granuli |
+ |
- |
- |
+ |
- |
W zależności od znaku elektrycznego jonów adsorbowanych w warstwie adsorpcyjnej cząstka koloidu może być naładowana ujemnie albo dodatnio (tab. 5.2). Sam znak ładunku elektrycznego nie jest jednak cechą charakterystyczną konkretnego koloidu. Ta sama cząstka koloidalna, w zależności od środowiska elektrolitu, może być raz obdarzona ładunkiem ujemnym, a raz dodatnim. Przykładem może być koloidalna zawiesina jodku srebra w wodzie otrzymywana w reakcji AgN03 i KI. Koloidalny jodek srebra Agi, wytrącony nadmiarem jonów Ag+ (w roztworze o większym stężeniu AgN03), jest naładowany dodatnio, zaś w roztworze zawierającym nadmiar jonów T (większe stężenie KI) wykazuje znak ujemny.
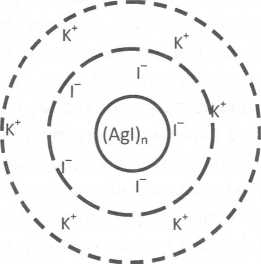
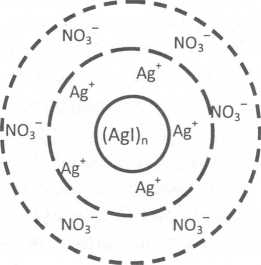
Rys. 5.1. Schemat miceli jodku srebra stabilizowanej a) nadmiarem KI, b) nadmiarem AgN03
W koloidach liofilowych na granicy fazy rozproszonej i rozpraszającej zachodzi zjawisko solwatacji, co powoduje, że do miceli złożonej z kłębka cząstek fazy zdyspergowanej przylega cienka otoczka ośrodka dyspersyjnego na stałe związana z micelą. Istnienie tej otoczki, jak wspomniano w rozdziale 5.3, warunkuje trwałość zoli liofilowych.
Na trwałość koloidalnych roztworów liofobowych wpływa występowanie ładunku elektrycznego na powierzchni cząstki koloidalnej oraz jego stabilność.
5.4.3. KOAGULACJA KOLOIDÓW ZA POMOCĄ ELEKTROLITÓW
Jak już wspomniano, trwałość roztworów koloidalnych jest spowodowana przede wszystkim elektrostatycznym odpychaniem się jednoimiennie naładowanych micel koloidalnych. Jednym ze sposobów koagulacji zoli jest zobojętnienie ładunków
Wyszukiwarka
Podobne podstrony:
Francuz5 34 O METODACH BADAŃ PSYCHOLOGICZNYCH Tabela 1.1 Przykład rangowa-nia ilorazów inteligencji
Metodyka analizy systemów zarządzania procesowego_353 Tabela 1. Przykład klasyfikatora procesów
skanuj0023 (123) WSPÓŁCZESNA TURYSTYKA KULTUROWA 27 Tabela 1. Przykłady wykorzystywania krajobrazu k
skanuj0038 (101) Tabela 14.6. Strategie cenowe usług turystycznych Startegia Cel strategii Sposób
skanuj0049 (38) 52 ANDRZEJ KOWALCZYK Tabela 4. Przykładowe atrakcje związane ze współczesną turystyk
skanuj0581 Tabela 6.4. Przykład punktowej oceny atrakcyjności sektora liczba punktów w tej wersji me
Tabela 2. Przykładowe konspekty części głównej lekcji z kajakarstwa Table 2. Exampłes of synopses of
Ćwiczenie 8 : Badanie własności wodorowych ogniw paliwowych (PEM) Tabela 1: Przykładowa tabela do wy
skanowanie0003 (68) Tabela 7.1 Przykłady reakcji występujących w procesach biotransformacji
Jasiński Motywowanie w przedsiębiorstwie (22) Tabela 2.4 Przykład rozdzielczego systemu pre (tabela
więcej podobnych podstron