lastscan50

500 0,5 1000
= 0,25
cm* ■ mola cm!
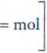
1 mol czystego NaOH ma masę 40,0 g, zatem 0,25 mola odpowiada:
1 mol — 40,0 g 0,25 mola — x2
=> x2 =
0,25-40,0
1
mol ■ g mol
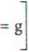
3. Na podstawie pomiaru areometrem stwierdzono że stosowany stężony roztwór NaOH ma gęstość 1,500 g/cm3, co wg tabeli 8 oznacza stężenie ok. 47,5%. Zatem, z definicji stężenia procentowego, w 100 g takiego roztworu znajduje się 47,5 g czystego wodorotlenku, a więc potrzebna ilość NaOH (10,0 g) znajdzie się w następującej masie roztworu stężonego:
47,5 g NaOH 10,0 g NaOH
100 g roztworu 10,0 • 100 ,,,
r =**3=-4Z5- = 2W
Xj
=g
4. Roztwory znacznie wygodniej jest odmierzać objętościowo niż ważyć; na podstawie gęstości oblicza się objętość stężonego roztworu NaOH potrzebną do sporządzenia przygotowywanego roztworu rozcieńczonego. Wyniesie ona:
lcm3 roztworu NaOH — 1,500 g roztworu x, — 21,1 g roztworu
14,1
g - cm3 g

Do kolby miarowej zawierającej około 50 cm3 wody destylowanej wprowadzić odmierzoną pipetą objętość stężonego roztworu NaOH, dopełnić wodą destylowaną do kreski miarowej, zamknąć korkiem i dokładnie wymieszać.
Środki ostrożności
Stężony wodorotlenek sodu jest substancją silnie żrącą, jest szczególnie niebezpieczny dla oczu - pracować bezwzględnie w okularach ochronnych.
Pytania dodatkowe
1. Dlaczego sporządzany roztwór NaOH nie może być użyty w roli substancji podstawowej?
2. Dlaczego mianowanego roztworu NaOH nie można przygotować przez odważenie wodorotlenku?
3. Dlaczego mianowany roztwór NaOH należy przechowywać szczelnie zamknięty i co pewien czas sprawdzać jego dokładne stężenie?
6.2.5. Mianowanie roztworu wodorotlenku sodu za pomocą
roztworu kwasu szczawiowego o stężeniu 0,0500 mol/dm3
Odczynniki Szkło i aparatura
Roztwór wodorotlenku sodu o stę- Pipeta Mohra (10,00 cm3), biureta, kolba
żeniu ok. 0,1 mol/dm3, roztwór stożkowa (200-300 cm3).
kwasu szczawiowego o stężeniu
0,0500 mol/dm’, 0,5 % etanolowy
roztwór fenoloftaleiny.
Wykonanie
Do kolby stożkowej o pojemności 250 cm3 dokładnie odmierzyć 10,00 cm3 roztworu kwasu szczawiowego o stężeniu 0,0500 mol/dm’, dodać 1-2 krople roztworu fenoloftaleiny i rozcieńczyć próbkę niewielką ilością wody destylowanej (roztwór pozostaje bezbarwny). Następnie miareczkować roztworem wodorotlenku sodu o stężeniu ok. 0,1 mol/dm3 z przygotowanej uprzednio biurety. Miareczkowanie zakończyć w momencie pojawienia się trwałego (tzn. utrzymującego się co najmniej przez 30 sekund bez mieszania) bladoróżowego zabarwienia. Po zakończeniu miareczkowania odczytać poziom roztworu NaOH w biurecie, a następnie obliczyć stężenie titranta z dokładnością do 0,0001 mol/dm3.
Przykładowe obliczenia.
Zadanie: Obliczyć dokładne stężenie roztworu wodorotlenku sodu, jeśli na miareczkowanie 20,00 cm3 roztworu kwasu szczawiowego o stężeniu 0,1000 mol/dm3 zużyto 19,40 cm3 roztworu tego wodorotlenku.
1. W 1000 cm3 roztworu kwasu szczawiowego o stężeniu 0,1000 mol/dm3 znajduje się 0,1000 mola czystego chemicznie kwasu, zatem w 20 cm3 powinno się go znaleźć:
20 0,1000 1000
1000 cm3 — 0,1000 mola 20 cm3 —
= 0,002000 = 2,000 • KP’
cm3 ■ mol cm3
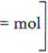
2. Zgodnie z równaniem reakcji: 2 NaOH + H2C204 -ż Na2C204 + 2 H20
1 mol H2C204 reaguje z 2 molami NaOH, zatem 2,000 10'3 mola kwasu reaguje z:
lmolHjCjO, — 2 mole NaOH ^ 2-2.000-10~1 _ 1Q00 1Q-a~
2,000 10 ’mola H2C A —x2 mola NaOH * 1
mol mol mol
= mol
NaOH
99
Wyszukiwarka
Podobne podstrony:
Finanse 3 2Q.0ccniamy 3 projekty inwestycyjne, wybierz najlepszy I NPV 500 IRR 25%pi/ /C ifi/Z 21 .J
24AF? MIASTA: Powyżej 5.000.000 1.000.000-5.000.000 500.000- 1.000.000 100.000 - 500.000 25.000
lastscan52 3. 1 mol HjSO^ ma masę 98,09 g, zatem 4,985 ■ 104 mola odpowiada: lmol H,SO, — 98,09 g &n
24AF? MIASTA: Powyżej 5.000.000 1.000.000-5.000.000 500.000- 1.000.000 100.000 - 500.000 25.000
24AF? MIASTA: Powyżej 5.000.000 1.000.000-5.000.000 500.000- 1.000.000 100.000 - 500.000 25.000
1000.75Ciśnienie Ciśnienie [hPa] 1000.5 1000.25 1000 999.75 18:27
Podstawą prostopadłościanu jest kwadrat o boku długości 3 cm. Przekątna ściany bocznej ma długość 5
Zdjęcie0077 Wflńr Venwtt 1 fv*k>gMwo F II fokyw w> F • * Cm-C^F:- R ■ 5*3! [I K mol) &nb
najmniejsze kwadraty dojscie do wzoru5 czesc2 jpeg jpeg * A-42 2H Z%] -fc„ v<J] = o *”$*& CM
CCI20080412�021 1. Dane są dwa wektory a i b o długościach odpowiednio 3 cm i 4 cm. Jeżeli wypadkowy
Zad. 2. Obwód równołegłoboku jest równy 17 cm, a jeden jego bok, ma długość 3— cm. OóCicz długość
1614477B7496137353399!29775686 o Mo. CM %a.d<aa,e 3. a) cyjanek x>ou: Ma. CM * &nb
więcej podobnych podstron