Scan0055 2

I
Dlatego też metale alkaliczne są miękkie, mają niską temperaturę topnienia (Rb 38,9°C; Cs 28,7°C), podczas kiedy metale ziem alkalicznych mają większą gęstość, twardość i wyższą temperaturę topnienia (Ca 838°C; Ba 714°C).
3.8. SŁABSZE WIĄZANSA MIĘDZYATOMOWE I MIĘDZYCZĄSTECZKOWE
Poza podstawowymi typami wiązań chemicznych wyróżniamy jeszcze słabsze wiązania między atomami. Należą do nich siły van der Waalsa (J. D. van der Waals, fizyk holenderski, 1837—1923) i wiązanie wodorowe, występujące najczęściej pomiędzy sąsiednimi cząsteczkami określonych związków.
3.8.1. WIĄZANIA WODOROWE
Na rysunku 39 przedstawione są temperatury wrzenia związków wodoru z pierwiastkami głównymi grupy czwartej, piątej, szóstej i siódmej;
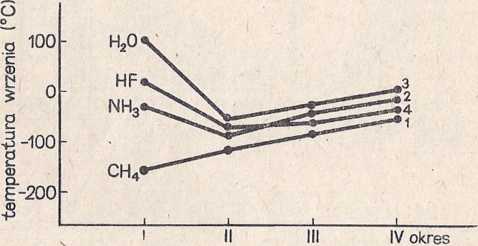
Rys. 39. Porównanie temperatur wrzenia związków wodoru z pierwiastkami rodzin głównych 4—7
krzywa 1 przedstawia temperatury wrzenia następujących związków (od lewej do prawej): CH4, SiH4, GeH4, SnH4; krzywa 2: NH3, PH3, AsH3, SbH3; krzywa 3: H20, H2S, H2Se, H2Te; krzywa 4: HF, HC1, HBr, HI.
Z rysunku tego wynika wyraźnie, że trzy związki z udziałem wodoru (HF, NH4, FI20) mają o wiele wyższe temperatury wrzenia niż pozostałe z tej grupy układu okresowego. Wynika z tego, że pomiędzy cząsteczkami tych związków istnieją siły przyciągania, zmieniające ich charakter w stosunku do pozostałych. Wyjaśniamy je istnieniem wiązania wodorowego.
Wiązanie wodorowe powstaje w większości związków zawierających atom wodoru połączony z atomem fluoru, azotu lub tlenu, względnie-z atomami pierwistków o dużej elektroujemności i małym promieniu atomu. Na przykład dla wody każdy atom wodoru połączony wiązaniem kowalencyjnym z tlenem oddziałuje dodatkowo z wolną parą elektronów (por. tabela 23) na atomie tlenu sąsiedniej cząsteczki wody, tworząc słabsze międzycząsteczkowe wiązanie wodorowe.
Istnieniem wiązań wodorowych można więc wyjaśnić różny od normalnego charakter wspomnianych związków (wyższa temperatura wrzenia i topnienia, moc kwasów itd.).
3.8.2. SIŁY VAN DER WAALSA
Ich istnienie pomiędzy atomami i cząsteczkami wyjaśnia np. zachowanie się atomów i cząsteczek w stanie gazowym różniące się od zachowania teoretycznego (idealnego). Tylko dlatego, że pomiędzy cząstkami działają pewne siłv przyciągające, istnieje możliwość przemiany w stan ciekły i stały.
YV tabeli 27 podane są przykłady atomów gazów szlachetnych, pomiędzy którymi działają jedynie siły van der Waalsa, utrzymując je razem. Wielkość tych sił podawana jest w jednostkach erg -cm6. Dla porównania podajemy także temperatury wrzenia odpowiednich pierwiastków.
Tabela 27
|
Pierwiastek |
[Erg • cm6] |
Temperatura wrzenia |
|
He |
1,2 |
—269°C |
|
Ar |
52,0 |
—185°C |
|
Xe |
217,0 |
— 108°C |
Zwróćcie uwagę, jak wraz ze wzrostem sił van dei Waalsa wzrasta, także temperatura wrzenia gazów szlachetnych.
W tabeli 28 obok gazów szlachetnych podane są cząsteczki pierwiastków pomiędzy którymi w stanie stałym działają jedynie siły van der Waalsa.
107
Wyszukiwarka
Podobne podstrony:
Chemia rep48 Helowce są chemicznie bierne, mają niskie temperatury topnienia i wrzenia, a w fazie ga
skanowanie0057 2 192 Dlatego też rotacja jest uznawana za krok w kierunku humanizacji pracy, choć je
skanuj0016 Najtańsze są loty w środku i tygodnia. Dlatego też najlepiej zaczynać podróż wc i wt
Obraz (204) Ale dzieci o tym wszystkim nie wiedzą. Dlatego też te, idące w pochodzie krzyżowym w Bra
CCF20091123�010 76 < Franciszek Sztabiński sens badań i uważają, że są one potrzebne”. Dlate
zegary3 Oprócz zegarków ze wskazówkami są też zegarki elektroniczne, które nie mają wskazówek, tylko
Zdjęcie0317 Interfejsy użytkownika uważane są ża krytyczny element systemów informatycznych dlatego
10 Rozdział 2 2.2. Mechanizmy umocnienia i plastyczność polikryształów Metale czyste są bardzo miękk
DSC?54 (2) jakże są żywe! Mają przed sobą całe życie, ale one też są już martwe (dzisiaj), były więc
więcej podobnych podstron