3

Wnioski z I zasady termodynamiki
Wnioski z I zasady termodynamiki
L = 0 -> Q = AU AU = 0 —» Q = L L = -AU
- dla przemiany izochorycznej (V = const)
- dla przemiany izotermicznej (T = const)
- dla przemiany adiabatycznej (Q = 0)
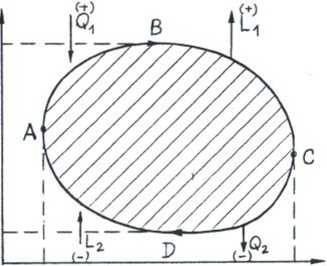
Cykl termodynamiczny (proces kołowy) - ciąg procesów' (przemian), które doprowadzają z powrotem układ do warunków początkowych. Rzeczywiste cykle są nieodwracalne (dysypacja energii), ale dla uproszczenia posługujemy się modelem przybliżonym -» cykl odwracalny, ąuasistatyczny, maszyna (silnik, sprężarka) - doskonale izolowana.
Sprawność silnika cieplnego w cyklu odwracalnym (z I zasady termodynamiki)
Qi=Uc -Ua+Li
~Q2 -Uc ^L2 (Lz*-La)
Ql -Q2 =L1 ~L2 = L
L Qi-Q2_1 Q2 ^ Qi Qi Qi
sprawność silnika cieplnego w cyklu odwracalnym
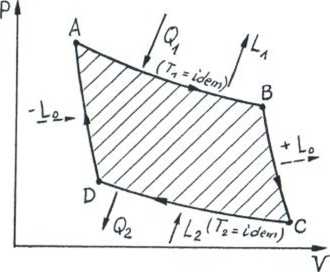
Obieg (cykl) Carnota AB, CD - izotermy BC, DA - adiabaty praca adiabatycznego sprężania = pracy adiabatycznego rozprężania L0
(Q = 0)
*IC =
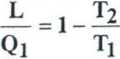
sprawność, jakiej nie może przekroczyć najdoskonalszy silnik (sprawność rzeczywistego obiegu rn nieodwracalnego będzie Ji jeszcze mniejsza)
rz
<
• Tylko część ciepła doprowadzonego do układu uzyskujemy w postaci pracy
sformułowania
• Niemożliwe jest przekazywanie ciepła ciału o temperaturze wyższej przez ciało o temperaturze niższej bez włożenia pracy z zewnątrz
• Niemożliwe jest skonstruowanie perpetum mobile Ii-go rodzaju (maszyny czerpiącej ciepło z jednego źródła,
np. z oceanu, i zamieniającej je na pracę) _>
Odwrotny cykl termodynamiczny - np. chłodziarka; pompa ciepła
(me irujUc z procesem odwracalnym)
(uzupełnienie termodynamiki statystycznej - kinetycznej teorii gazów)
<ek}!s,=5kT
Zasada ekwipartycji energii- energia rozkłada się równomiernie na wszystkie rodzaje ruchu (postępowy, obrotowy, drgający);
- na każdy stopień swobody cząsteczki
- dla gazu 1-atomowego
(v = 3),(ek) = -kT;* = cp/cv = 5/3 s 1,67 2
(hel i inne gazy szlachetne)
dla gazu 2-atomowego (v = 5),(ek) = - kT; x = 7/5 = 1,4
2
(bezuwzgl. ruchu drgającego), np.02 ,N2
|
i dn | |||
|
di/ |
/IX |
/I* |
/T2>T, |
|
f 1 \ 1 > V/ < 1 |
/ |
'd
Rozkład Maxwella dla prędkości /fi gazu doskonałego (ustalony teoretycznie)
• n- liczba cząstek w jedn. objętości
• f(v)- prawdopodobieństwo (gęstość
prawdopodobieństwa)
) pr cf/a, (jazu 3- 6cłowoiv^o Cv~6)
<\eK^ = §; kT = SkT ; (w aeOUfWtrłosci' *S W-(i » irty/ęclu
Ca. udzraC enenju ruchtc drj°-]va<jo)
Wyszukiwarka
Podobne podstrony:
Wnioski z 1 zasady termodynamiki L = 0 —» Q = AU AU = 0 -» Q = L L = -AU - dl
Slajd64 Pierwsza zasada termodynamikiQ = AU + p AV dla p = const. Kosztem ciepła Q zwiększa się ener
Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana energ
35456 Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana
35456 Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana
DSCN4690 Z tymi wnioskami wiążą się różne sformułowania drugiej zasady termodynamiki. William Thomso
fizyczna egzamin001 Chemia fizyczna I (termodynamika) 1. Zmiana energii wewnętrznej układu AU w ogól
IMAG0041 Historyczni* najstarsze sformułowanie I zasady termodynamiki Sumaryczna energia Wszechświat
IMAG0097 Chemia Jizyaiia • Termodynamika ZASADY TERMODYNAMIKI ENERGIA WSZECHŚWIATA JEST STAŁA (I zas
więcej podobnych podstron