3

Wnioski z 1 zasady termodynamiki
L = 0 —» Q = AU AU = 0 -» Q = L L = -AU
- dla przemiany izochorycznej (V = const)
- dla przemiany izotermicznej (T = const)
- dla przemiany adiabatycznej (Q = 0)
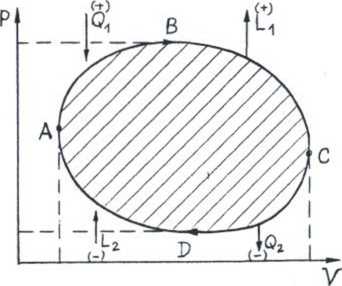
Cykl termodynamiczny (proces kołowy) - ciąg procesów (przemian), które doprowadzają z powrotem układ do warunków początkowych. Rzeczywiste cykle są nieodwracalne (dysypacja energii), ale dla uproszczenia posługujemy się modelem przybliżonym —» cykl odwracalny, ąuasistatyczny, maszyna (silnik, sprężarka) - doskonale izolowana.
Sprawność silnika cieplnego w1 cyklu odwracalnym (z 1 zasady termodynamiki)
<3.= UC -U.+L,
-Q» = u« -uc “L2
Ql -Q2 =Lj -L2 =L
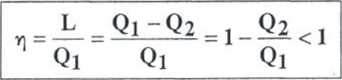
sprawność silnika cieplnego w cyklu odwracalnym
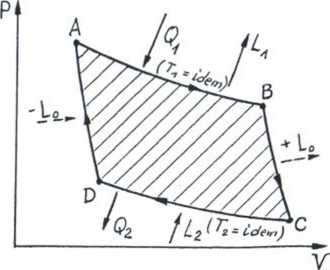
Obieg (cykl) Carnota AB, CD - izotermy BC, DA - adiabaty praca adiabatycznego sprężania = pracy adiabatycznego rozprężania L0
(Q = 0)
sprawność, jakiej nie może przekroczyć najdoskonalszy silnik (sprawność
Ql T,
»lc =
rzeczywistego obiegu rn < 00
nieodwracalnego będzie Ł ^ c
jeszcze mnie
Drui-»a zasada termodynamiki (n < l)
BIUBAiO|mtUOJS
• Tylko część ciepła doprowadzonego do układu uzyskujemy w postaci pracy
• Niemożliwa jest przekazywanie ciepła ciału o temperaturze
wyższej przez ciało o temperaturze niższej bez włożenia l pracy z zewnątrz [
• Niemożliwe jest skonstruowanie perpetum mobile Ii-go
rodzaju (maszyny czerpiącej ciepło z jednego źródła, np. z oceanu, i zamieniającej je na pracę) j
Odwrotny cykl termodynamiczny - np. chłodziarka; pompa ciepła
Cme irujUc z procesem odwracalnym)
(uzupełnienie termodynamiki statystycznej - kinetycznej teorii gazów)
Wis,=5kT
Zasada ekwipartycji energii - energia rozkłada się równomiernie na wszystkie rodzaje ruchu (postępowy, obrotowy, drgający);
- na każdy stopień swobody cząsteczki
- dla gazu 1-atomowego
(v = 3),(ej<) = - kT; x = Cp/cv =5/3 = 1,67 2
(hel i inne gazy szlachetne)
- dla gazu 2-atomowego (v = 5),(e k) = ^ kT; *• = 7/5 = 1,4 (bez uwzgl. ruchu drgającego), np.02 ,N2
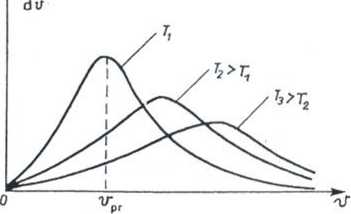
Rozkład Maxwella dla prędkości /W,i gazu doskonałego (ustalony teoretycznie)
• n- liczba cząstek w jedn. objętości
• f(v)- prawdopodobieństwo (gęstość
prawdopodobieństwa)
*)
otloo gozu 3 - cdroMowego Cv ~ 6)
^K>'s§ kT = 3kT ; #=-§-=■/,33 (w aeeuji*rk»c4 ^ u^/fJcc
h U^JzroS c,nctyu ruch cc
Wyszukiwarka
Podobne podstrony:
Wnioski z I zasady termodynamiki Wnioski z I zasady termodynamiki L = 0 -> Q = AU AU = 0 —» Q = L
DSCN0500 Ekosystem a zasady termodynamiki I. Zasada zachowanie energii W żadnych p
Slajd64 Pierwsza zasada termodynamikiQ = AU + p AV dla p = const. Kosztem ciepła Q zwiększa się ener
img043 przy czym wartość au dla danego współczynnika ufności 1 - a wyznacza się z tablic standaryzow
P1120605 [1024x768] uniwersalnych co> R. AU- Dla elektrolitu 1-1 wartościowego flf+MiJ-l iq«o.S)
Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana energ
35456 Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana
35456 Zdjęcie054 (15) I zasada termodynamikiQ = AU + W O - ciepło dostarczone do układu. AU - zmiana
Zastosowanie I zasady termodynamiki dla gazu doskonałego Fizyczne właściwości gazu opisujemy za pomo
DSCN4690 Z tymi wnioskami wiążą się różne sformułowania drugiej zasady termodynamiki. William Thomso
skan0080 Termodynamika chemiczna 83 pomnożyć przez (-71 -TASZ = A Hf - TASf = AG°r. Jak widać, dla p
Wnioski Import danych z systemu visualNastran umożliwił obliczenie przemieszczeń i przyspieszeń dla
więcej podobnych podstron