skan0080

Termodynamika chemiczna 83
pomnożyć przez (-71
-TASZ = A Hf - TASf = AG°r.
Jak widać, dla przemiany samorzutnej AG < 0.
Przykład 3.18. Na podstawie poniższych danych w 25°C obliczyć ilość sa-:'naroży C12H22On, która byłaby w stanie pokryć dzienne zapotrzebowanie energetyczne człowieka (przyjmujemy, że wynosi ono 1000 kcal). Założyć, że reak-:ja spalania sacharozy do C02(g) i H20(C) zachodzi w 310 K oraz że w tym zalesie temperatur ACp reakcji jest stałe.
|
C,2H220i1(s) |
°2(g) |
C02(g) |
H20(C) | |
|
J 7/298 [kJ • mol ]] |
-2221 |
0 |
-393,51 |
-285,84 |
|
5° [J • K_1 • mol"1] |
360 |
205,13 |
213,7 |
69,96 |
|
Cp [J • K"1 • mor1] |
425 |
29,36 |
37,13 |
75,31 |
Rozwiązanie. Zadanie sprowadza się do obliczenia entalpii swobodnej _'G° = AH° - TAS° reakcji spalania sacharozy
Ci2H220]i(S) + 12 02(g) - 12C02(g) + 11 H20(c).
Wyniki obliczeń, analogicznych jak wr przykładzie 3.17, entalpii i entropii reakcji w' tych temperaturach, zestawiono w' tabeli poniżej. Na tej podstawie obliczono AG° i masę sacharozy.
|
T[ K] |
ACp [J ■ K-1 • mol"1] |
AH° [kJ • mol-1] |
AS0 [J • K'1 • mol"1] |
AG0 [kJ • mol’1] |
masa [g] |
|
298,15 |
496,65 |
-5645,36 |
512,4 |
-5798,13 |
247,01 |
|
310,0 |
496,65 |
-5639,47 |
531,76 |
-5804,32 |
246,74 |
W 310 K jeden mol sacharozy (342,3 g) może dostarczyć 5804,3 kJ, które mogą być zamienione na pracę, toteż należałoby zjeść, teoretycznie, blisko 247 g sacharozy. ■
Zależność entalpii swobodnej G i energii swobodnej F od parametrów stanu określają ich różniczki zupełne
(3.61)
(3.62)
dG = -SdT + Vdp,
dF = -SdT - pdV,
z których wrynikają następujące ważne relacje:
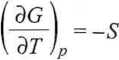
oraz
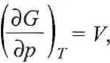
(3.63)
Wyszukiwarka
Podobne podstrony:
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
66861 skan0052 Termodynamika chemiczna 55 W = -nRTl ln P Pl = -3-8,314-298,15- In 100 120 = 1355,83
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
więcej podobnych podstron