skan0068

Termodynamika chemiczna 71
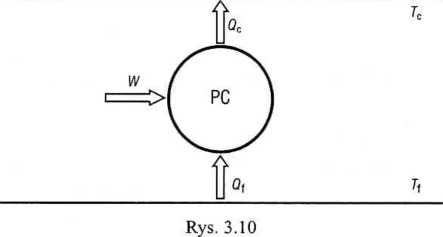
ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem, uwzględniane dodatkowo wyrażenie (3.40), otrzymujemy
Qc = Tc
r] W Tc - Tf '
Przy zmieniającej się cały czas temperaturze zbiornika poprawniej jest ją zdefiniować jako wielkość chwilową, zależną od temperatury'
(gęk _ T nr Wd T-Tf •
Tak więc:
(<2c)d = ~mcdT=-Wcl T => WeX = T Tf mcdT.
1 — 1 f 1
-o scałkowaniu w granicach od Tp = 288 K, do Tk = 353 K otrzymamy wartość
pracy
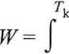
m c
T-Tf
dT - m c
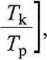
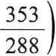
31 • 103 kJ (8,6 kWh).
W= 4,184- 103 65 - 283 - In
W podobny sposób możemy obliczyć ilość ciepła dostarczonego do zbiorni-•_a z wodą
h
2c = -J mcdT = —mc
_atem Qc = -1000 ■ 4,184 • 65 = -272 ■ 103 kJ, a z równania bilansu (I zasada) W+ ~ Qc + Qf = 0 możemy obliczyć ciepło pobrane z jeziora i równe Qf = 241 • 103 kJ.
b) podgrzewając wodę energią grzałki elektrycznej równą obliczonej pracy W, “zożna osiągnąć temperaturę końcową
Wyszukiwarka
Podobne podstrony:
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
71404 skan0092 (2) Termodynamika chemiczna 95^0 = (Iv,^.)g jest równa różnicy między objętością gazo
skan0056 Termodynamika chemiczna 59 Łatwo sprawdzić, że obliczając pracę w procesie nieodwracalnym z
skan0080 Termodynamika chemiczna 83 pomnożyć przez (-71 -TASZ = A Hf - TASf = AG°r. Jak widać, dla p
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
więcej podobnych podstron