skan0056

Termodynamika chemiczna 59
Łatwo sprawdzić, że obliczając pracę w procesie nieodwracalnym ze wzoru 13.25), przy wykorzystaniu wartości parametrów z powyższej tabeli, otrzymamy taki sam wynik (-450 J). ■
Przykład 3.5. W izoentalpowym procesie Joule’a-Thomsona gaz rzeczywisty ulega adiabatycznej ekspansji, w której

- /*//»
gdzie pH jest tzw. współczynnikiem Joule’a-Thomsona. Dla powietrza w 0°C, uH = 0,249 K • atm-1 dla px = 20 atm oraz pH = 0,266 K ■ atirf1 dla p2 = 1 atm. Obliczyć, o ile obniży się temperatura powietrza w adiabatycznym procesie ekspansji od 20 atm do 1 atm.
Rozwiązanie. Z definicji współczynnika Joule’a-Thomsona wynika, że
Pi
AT= J pHdp.
Pi
Na podstawie powyższych danych, zależność ciśnieniowa współczynnika Joule?a-Thoinsona w tym zakresie jest linią prostą o równaniu
pH= a + bp = 0,26689 - 8,9474 • 10~4 p, toteż, po scałkowaniu, otrzymamy
AT=a(p2-p\) + \ipl-p\) =
8 9474
= 0,26689 • (-19)- 2 ' 10-4-(1 -400) = -4,89 K.
W gazach rzeczywistych, poniżej temperatury inwersji^, gdziepH> 0, adiabatyczne rozprężanie gazu związane jest z wykonaniem pracy przeciwko siłom przyciągania cząsteczek. Dla gazu idealnego, oczywiście, pH= 0, gdyż
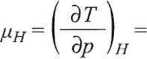
T (d V/d T)p - V
Standardowa entalpia tworzenia AH29% związku chemicznego jest zmianą entalpii fikcyjnej reakcji tworzenia 1 mola tego związku z pierwiastków w ich fazach stabilnych w warunkach standardowych (298,15 K, 1 bar). W starszych
(n Te temperatur)’ są zwykle dość wysokie, np. dla powietrza Tinw = 760 K. Wyjątkiem jest wodór (7jnw = 204,7 K) i hel (Tinw = 40 K).
Wyszukiwarka
Podobne podstrony:
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
skan0078 (2) Termodynamika chemiczna 81 Przykład 3.17. Na podstawie poniższych danych w 25°C obliczy
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
więcej podobnych podstron