22460 skan0054
Termodynamika chemiczna 57
We\ = n CydT. (3.24)
Pracę gazu idealnego podczas odwracalnej przemiany adiabatycznej (zob.
111))
pVK = p[VlK = p2V2K nożna również obliczyć, całkując równanie (3.3)
w = -j p2JV=-Pl(7j -jT =
i'i
(3.25)
PjJjL (yi-K_ vi-*} = Ml-PlTl
- 1 K - 1
Równanie to może być także stosowane przy przemianach nieodwracalnych ale tylko dla gazówr idealnych), gdyż
Pi^j~P\ V\ k- 1
= nCv(T2 - 7j).
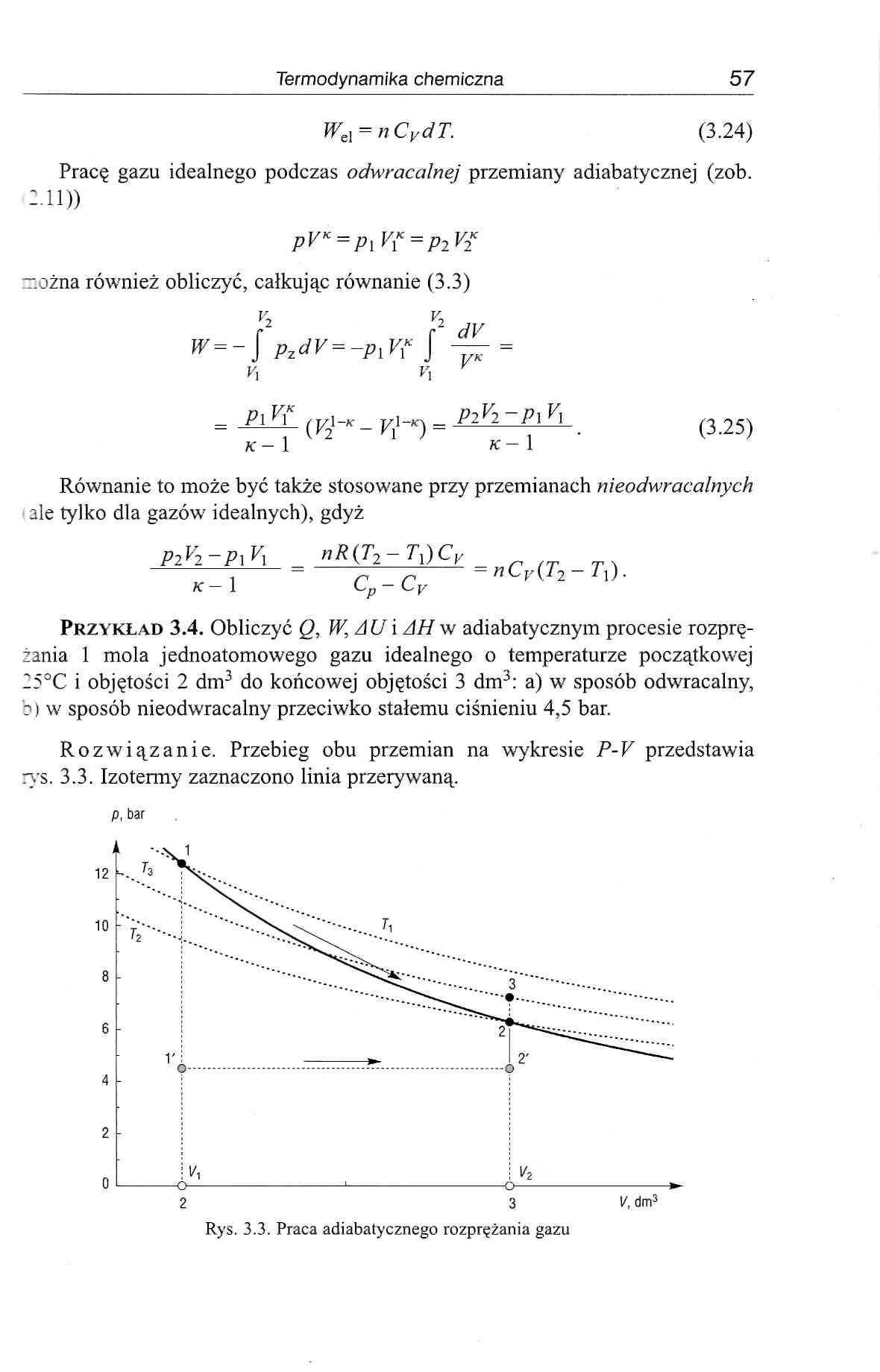
Przykład 3.4. Obliczyć Q, W,AU\ AH w adiabatycznym procesie rozprężania 1 mola jednoatomowego gazu idealnego o temperaturze początkowej 25°C i objętości 2 dm3 do końcowej objętości 3 dm3: a) w sposób odwaracalny, b) w sposób nieodwracalny przeciwko stałemu ciśnieniu 4,5 bar.
Rozwiązanie. Przebieg obu przemian na wykresie P-V przedstawia rys. 3.3. Izotermy zaznaczono linia przerywaną.
p, bar
Wyszukiwarka
Podobne podstrony:
skan0056 Termodynamika chemiczna 59 Łatwo sprawdzić, że obliczając pracę w procesie nieodwracalnym z
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
więcej podobnych podstron