41584 skan0070

Termodynamika chemiczna 73
Analogicznie dla entalpii dH(T, p)
dH(p, T) = (4^ dp + (-|jr) dT = + Vdp,
podstawiając wyrażenie na różniczkę zupełną entropii dS(T,p), można wyprowadzić
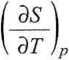
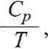
(3-46)
i także drugie termodynamiczne równanie stanu
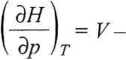
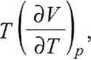
(3.47)
gdyż
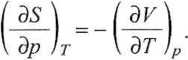
(3.48)
Przykład 3.14. Do 100 g zimnej wody o temperaturze 10°C w doskonale izolowanym naczyniu Dewara dodano 50 g gorącej wody o temperaturze 80°C. Średnie ciepło molowe wody w tym przedziale temperatur wynosi 75,5 J • K-1 • mol-1. Obliczyć zmianę entropii układu.
Rozwiązanie. Temperaturę wody po wymieszaniu (Tc) otrzymuje się z równania bilansu ciepła (zob. przykład 3.8):
m2
HoO
H,q (Te - ^l) +
mh2o
C/;,H2Q (T? _ T2) ~ 0,
T = 1
mj 7) + m2 T2 100 • 283,15 + 50 • 353,15
Wj + m2
100 + 50
= 306,48 K.
Zmiana entropii tego układu jest sumą zmiany entropii podczas ogrzewania 100 g wody od 283,15 K do 306,48 K (AS)) i zmiany entropii podczas chłodzenia 50 g wody od temperatury7 353,15 K do 306,48 K (dS2). Całkowanie równania (3.46) jest szczególnie proste, gdy pojemności cieplne nie zależą od tempera-:ury. Otrzymujemy wtedy
.dS] = «j Cp ln
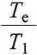
100
18,015
• 75,5 ln
306,48
283,15
= 33,18 J K-1,
AS2 = n2 Cp ln
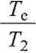
50
18,015
• 75,5 ln
306,48
353,15
-29,70 J- K-1.
Wyszukiwarka
Podobne podstrony:
71118 skan0088 Termodynamika chemiczna 91 Wyznaczyć dla każdego składu: a) AG początkowe reakcji, b)
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
70187 skan0058 Termodynamika chemiczna 61 Przykład 3.7. Oszacować standardową entalpię tworzenia cie
12707 skan0090 (2) Termodynamika chemiczna 93 Dla reakcji odwrotnej takim reagentem będzie PC15 (v,
82021 skan0086 Termodynamika chemiczna 89 T p 7r = ~^T oraz pR = 1C &n
skan0080 Termodynamika chemiczna 83 pomnożyć przez (-71 -TASZ = A Hf - TASf = AG°r. Jak widać, dla p
więcej podobnych podstron