12707 skan0090 (2)
Termodynamika chemiczna 93
Dla reakcji odwrotnej takim reagentem będzie PC15 (v, = 1)
Termodynamika chemiczna 93
ś min
> —
Mi
i c'
Tak więc współrzędna chemiczna reakcji dla wszystkich składów musi się mieścić w przedziale
—c ^ ^ a.
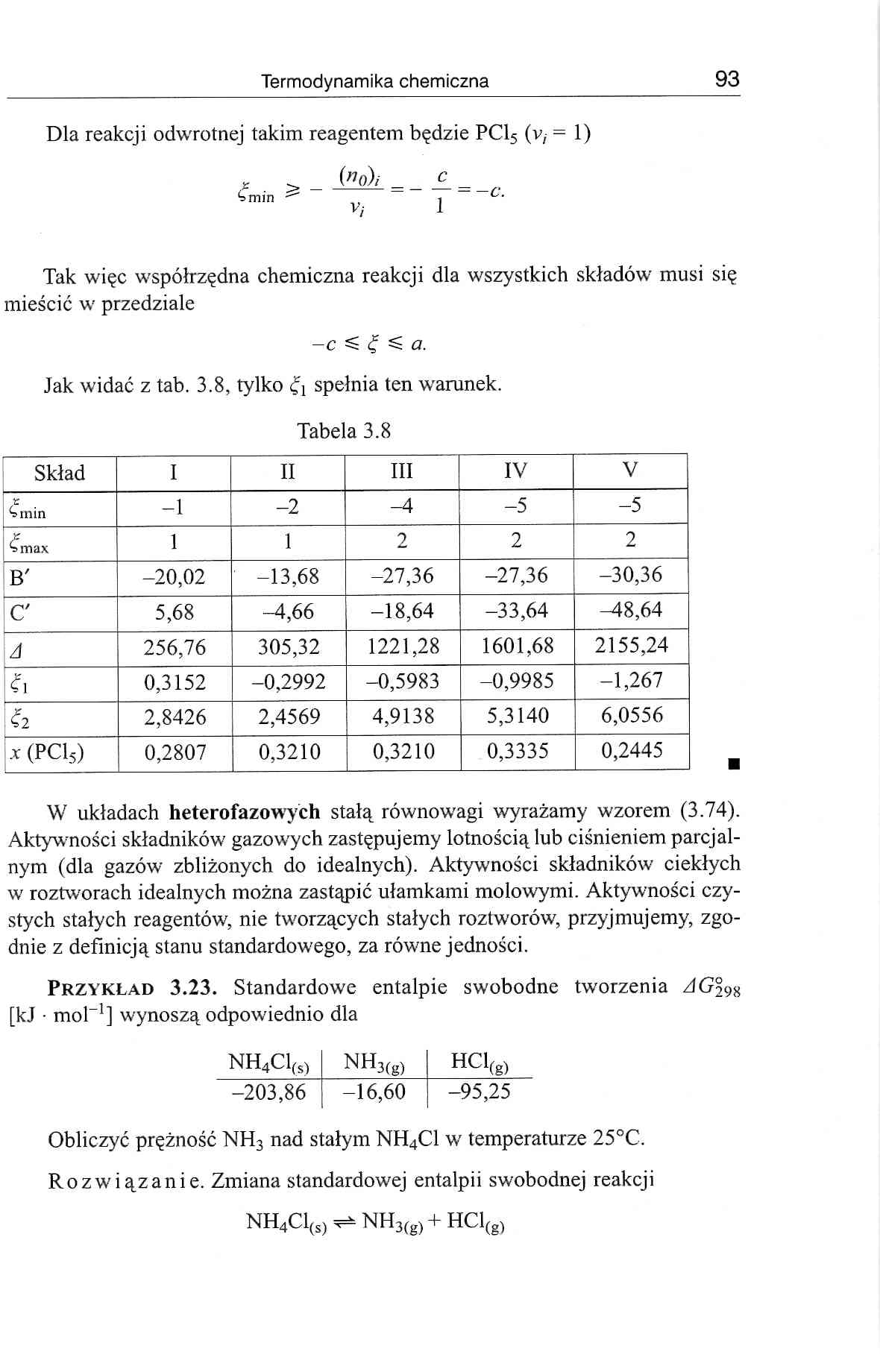
Jak widać z tab. 3.8, tylko £j spełnia ten warunek.
Tabela 3.8
|
Skład |
I |
II |
III |
IV |
V |
|
1 £ ^min |
-1 |
-2 |
-4 |
-5 |
-5 |
|
Lf l»max |
1 |
1 |
2 |
2 |
2 |
|
B' |
-20,02 |
-13,68 |
-27,36 |
-27,36 |
-30,36 |
|
C |
5,68 |
-4,66 |
-18,64 |
-33,64 |
^48,64 |
|
A |
256,76 |
305,32 |
1221,28 |
1601,68 |
2155,24 |
|
fi |
0,3152 |
-0,2992 |
-0,5983 |
-0,9985 |
-1,267 |
|
2,8426 |
2,4569 |
4,9138 |
5,3140 |
6,0556 | |
|
A (PC15) |
0,2807 |
0,3210 |
0,3210 |
0,3335 |
0,2445 |
W układach heterofazowych stałą równowagi wyrażamy wzorem (3.74). Aktywności składników gazowych zastępujemy lotnością lub ciśnieniem parcjalnym (dla gazów zbliżonych do idealnych). Aktywności składników' ciekłych w roztworach idealnych można zastąpić ułamkami molowymi. Aktywności czystych stałych reagentów', nie tworzących stałych roztworów', przyjmujemy, zgodnie z definicją stanu standardowego, za rówme jedności.
Przykład 3.23. Standardowe entalpie swobodne tworzenia AG^ [kJ • mol-1] wynoszą odpowiednio dla
|
nh4ci(s) |
NH3(g) |
HCl(g) |
|
-203,86 |
-16,60 |
-95,25 |
Obliczyć prężność NH3 nad stałym NH4C1 W' temperaturze 25°C. Rozwiązanie. Zmiana standardowej entalpii swobodnej reakcji NH4Cl(s)^NH3(g) + HCl(g)
Wyszukiwarka
Podobne podstrony:
71118 skan0088 Termodynamika chemiczna 91 Wyznaczyć dla każdego składu: a) AG początkowe reakcji, b)
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
82021 skan0086 Termodynamika chemiczna 89 T p 7r = ~^T oraz pR = 1C &n
skan0080 Termodynamika chemiczna 83 pomnożyć przez (-71 -TASZ = A Hf - TASf = AG°r. Jak widać, dla p
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
więcej podobnych podstron