64780 skan0066 (2)
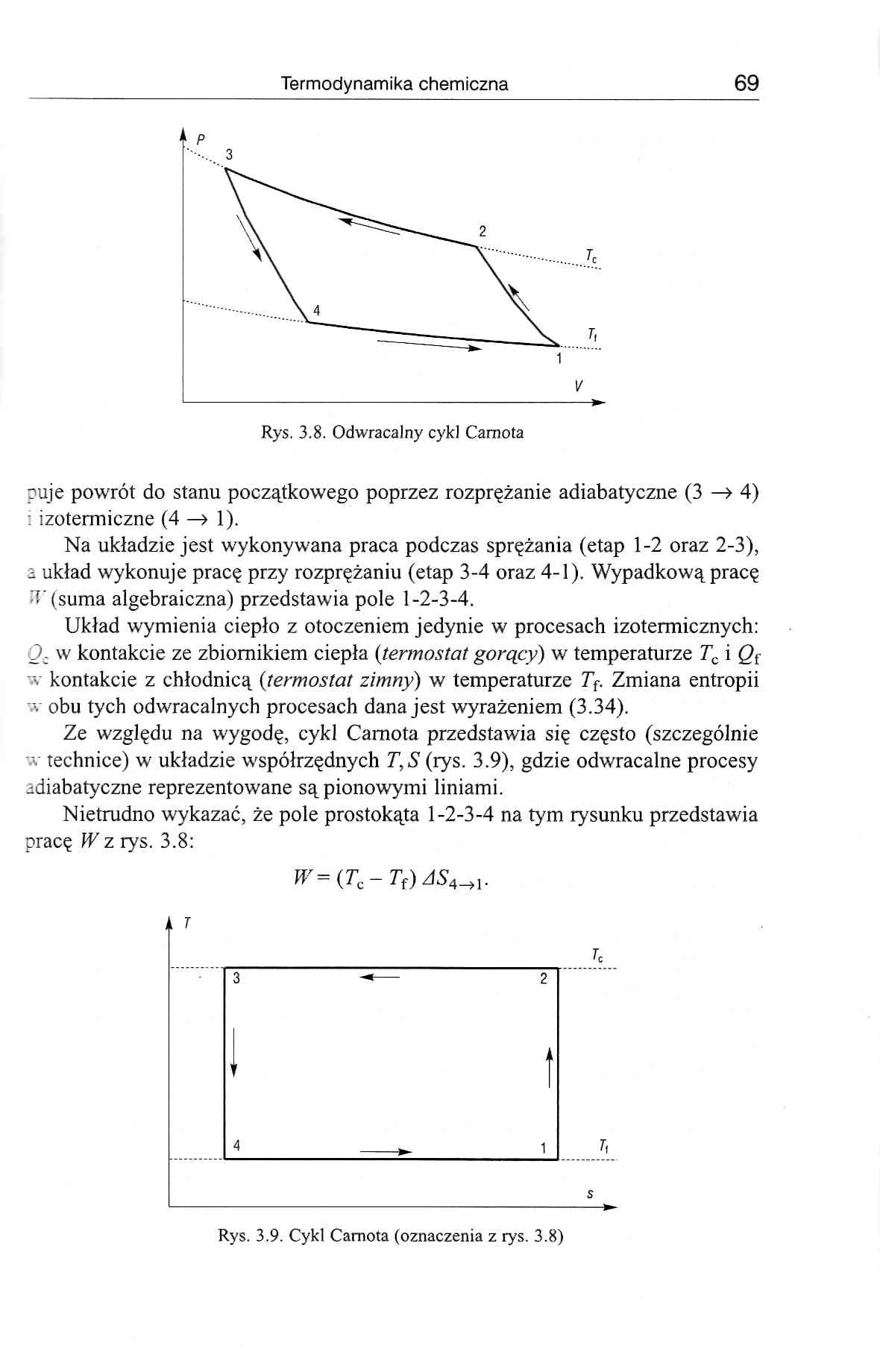
Termodynamika chemiczna 69
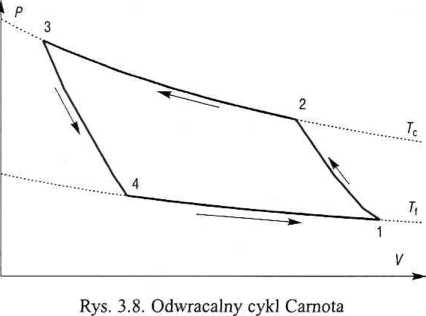
puje powrót do stanu początkowego poprzez rozprężanie adiabatyczne (3 —> 4) : izotermiczne (4 —> 1).
Na układzie jest wykonywana praca podczas sprężania (etap 1-2 oraz 2-3), i układ wykonuje pracę przy rozprężaniu (etap 3-4 oraz 4-1). Wypadkową pracę -'(suma algebraiczna) przedstawia pole 1-2-3-4.
Układ wymienia ciepło z otoczeniem jedynie w procesach izotermicznych: J- w kontakcie ze zbiornikiem ciepła (termostat gorący) w temperaturze Tc i Qt •• kontakcie z chłodnicą (termostat zimny) w temperaturze Tf. Zmiana entropii v obu tych odwracalnych procesach dana jest wyrażeniem (3.34).
Ze względu na wygodę, cykl Carnota przedstawia się często (szczególnie technice) w układzie współrzędnych T,S (rys. 3.9), gdzie odwracalne procesy adiabatyczne reprezentowane są pionowymi liniami.
Nietrudno wykazać, że pole prostokąta 1-2-3-4 na tym rysunku przedstawia pracę W z rys. 3.8:
W- (Tc - Tf) ASą^.
T
Tc
3
2
s
Rys. 3.9. Cykl Carnota (oznaczenia z rys. 3.8)
Wyszukiwarka
Podobne podstrony:
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
81615 skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i s
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
więcej podobnych podstron