skan0074

Termodynamika chemiczna 77
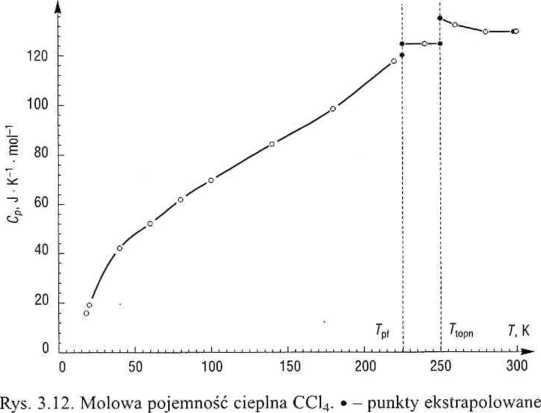
Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równania
3.55):
h Tp{
%8 = *S8+J aTl dr + J C/,(l)rflnT+^pf/rpf +
topn 2
+ J C/,(2)rfln7’ + J//topn/r,opn +J C„(3)</ln7\
fpf
' topn
W zakresie 0-18 K istnieje tylko jedna wartość Cp (w 18 K), toteż przyjęto za Debye’em, że w tym przedziale Cp(T) ~ a T3, co określiło jednoznacznie a. Zmianę entropii obliczono przez całkowanie wyrażenia (3.46), otrzymując
o
CP(T)
T
dT - a
Tx
J T2dT =
o
aTi3 _ Cp(Ti) 3
15,94
—j— = 5,31 J K"1- mor1.
Wartości pozostałych trzech całek (zob. rys. 3.13) najłatwiej obliczyć metodą trapezów, korzystając z arkusza kalkulacyjnego.
Aby zwiększyć dokładność, wygenerowano dodatkowe wartości Cp(i) na krańcach przedziałów; w fazie stałej, w 225,4 K - za pomocą równania 3 stopnia dla najbliższych pięciu punktów, a w fazie ciekłej, w 250,2 K - równaniem 2 stopnia. W obszarze fazy plastycznej dysponowano tylko jedną wartością Cp
Wyszukiwarka
Podobne podstrony:
skan0072 Termodynamika chemiczna 75 Zmiana entropii podczas przemiany fazowej zachodzącej w temperat
skan0078 (2) Termodynamika chemiczna 81 Przykład 3.17. Na podstawie poniższych danych w 25°C obliczy
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
75587 skan0067 70 Termodynamika chemiczna Sumaryczna zmiana entropii układu również będzie równa zer
41615 skan0077 80 Termodynamika chemiczna Zgodnie z (3.48) dla ciekłego CC14 mamy 80 Termodynamika
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
więcej podobnych podstron