75587 skan0067

70 Termodynamika chemiczna
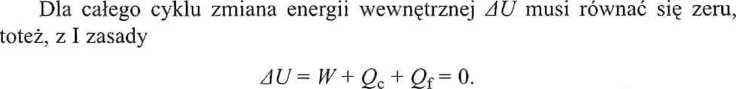
Sumaryczna zmiana entropii układu również będzie równa zeru i w ogólnym przypadku
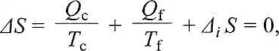
gdzie d, Sjest produkcją entropii wskutek nieodwracalności któregoś z procesów.
Dla odwracalnego cyklu Carnota, oczywiście, At S = 0, toteż, łącząc oba te równania, otrzymujemy wyrażenie wiążące ciepło i pracę, wymienione przez układ, z temperaturami termostatów, z którymi ten układ jest w kontakcie:
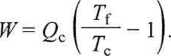
Urządzenia, w których następuje zamiana ciepła na pracę (lub odwrotnie), noszą nazwę maszyn cieplnych. Należą do nich:
a) silniki (My, które mogą wykonywać pracę W kosztem ciepła Qc, pobranego od „źródła ciepła” o temperaturze Tc. „Nadwyżkę” ciepła, Qf, oddają do chłodnicy o temperaturze 7}.
b) chłodziarki (F), odbierające od zbiornika zimna, w temperaturze Tf, ciepło <2f kosztem wykonanej na układzie pracy W. Część ciepła, <9C, oddają do. termostatu gorącego, o temperaturze Tc.
c) pompy cieplne (PC), oddające do gorącego termostatu ciepło Qc, kosztem wykonanej na układzie pracy W. „Brakujące” do bilansu ciepło Qt- pobierają ze zbiornika zimnego, o temperaturze T{.
Przykład 3-13. Pompę cieplną, pracującą odwracalnie, użyto do podgrzania do 80°C 1000 kg wody o temperaturze początkowej 15°C. Jako zbiornik zimny wykorzystano pobliskie jezioro o stałej temperaturze 10°C. Przyjmując średnie ciepło właściwe wody równe 4,184 kJ • K-1 • kg-1, obliczyć: a) pracę niezbędną do funkcjonowania pompy, b) temperaturę, do której można by podgrzać tę ilość wody, gdyby całą pracę zastąpić energią grzałki elektrycznej.
Ro z w i ąz an i e. a) Sprawność pompy cieplnej definiujemy, z punktu widzenia użytkownika, jako stosunek zysku (tu Qc) do kosztów (JV) - zob. rys. 3.10.
Ciepło Qc jest dostarczane przez układ do zbiornika z podgrzewaną wodą i zgodnie z przyjętą konwencją musi być traktowane jako ujemne, natomiast praca W, jako wykonywana na układzie, jest dodatnia. Zwyczajowo przyjmujemy,
Wyszukiwarka
Podobne podstrony:
skan0072 Termodynamika chemiczna 75 Zmiana entropii podczas przemiany fazowej zachodzącej w temperat
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
skan0049 (3) 52 Termodynamika chemiczna Zmiana entalpii jest równa ciepłu wymienionemu przez układ z
skan0073 76 Termodynamika chemiczna Entropia jest miarą stopnia nieuporządkowania. Im większa jest l
23105 skan0065 (2) 68 Termodynamika chemiczna 68 Termodynamika chemiczna (3.36) dSuk - QJT = djS. En
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
74354 skan0089 92 Termodynamika chemiczna Tabela
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
więcej podobnych podstron