66861 skan0052
Termodynamika chemiczna 55
W = -nRTl ln
P\
Pl
= -3-8,314-298,15- In
100
120
= 1355,83 J,
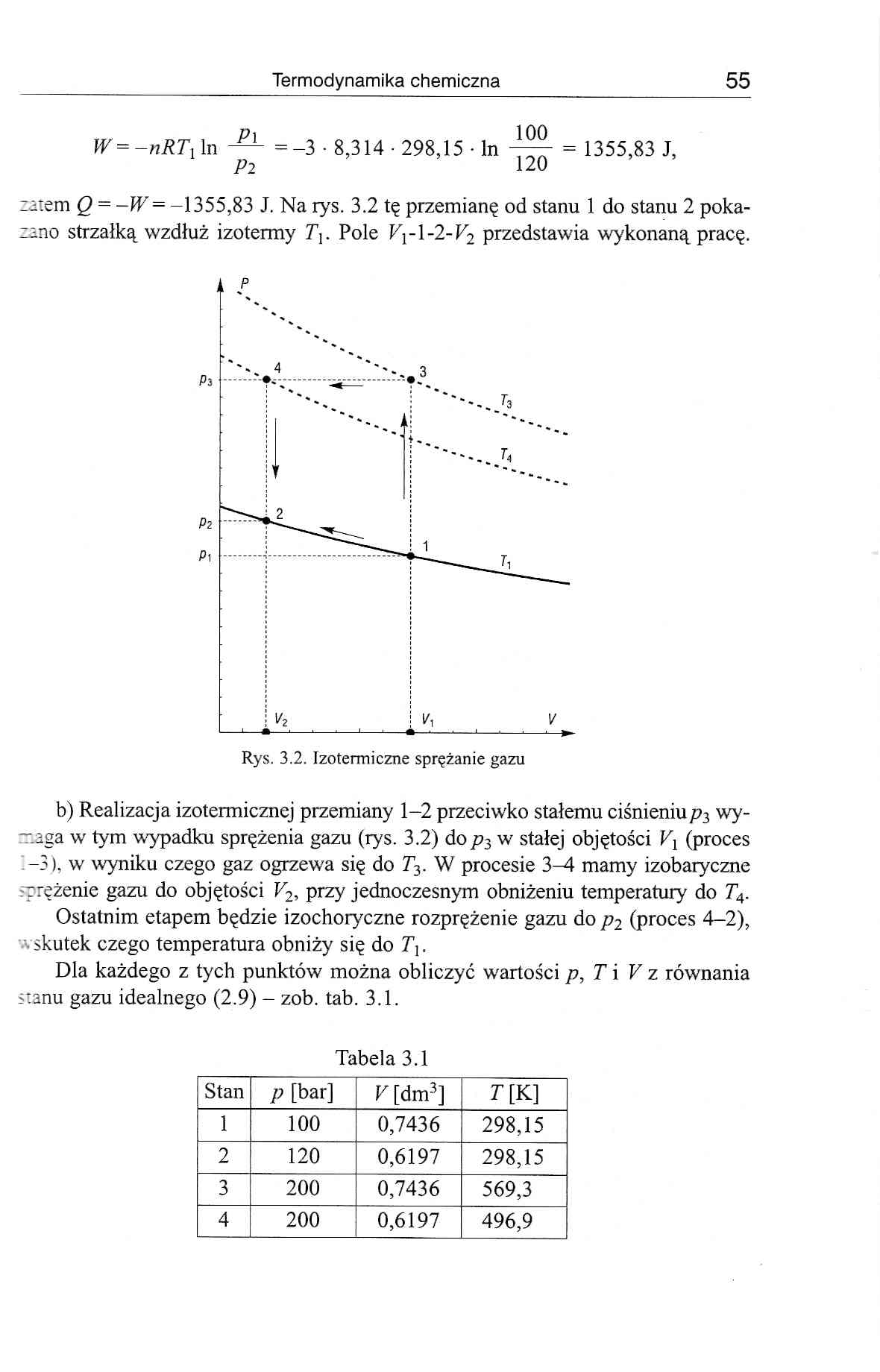
zatem Q = -W= -1355,83 J. Na rys. 3.2 tę przemianę od stanu 1 do stanu 2 pokazano strzałką wzdłuż izotermy 7). Pole Vrl-2-V2 przedstawia wykonaną pracę.
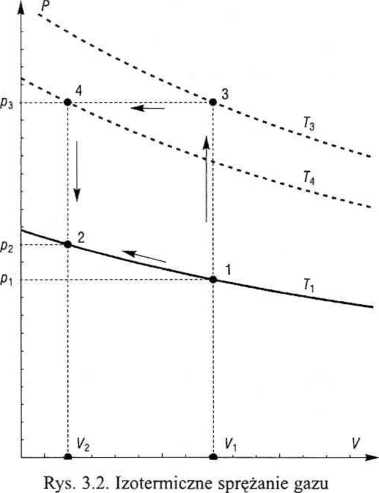
b) Realizacja izotermicznej przemiany 1-2 przeciwko stałemu ciśnieniup3 wy-zzaga w tym wypadku sprężenia gazu (rys. 3.2) do p3 w stałej objętości Vx (proces -3), w wyniku czego gaz ogrzewa się do T3. W procesie 3-4 mamy izobaryczne rzężenie gazu do objętości V2, przy jednoczesnym obniżeniu temperatury do T4.
Ostatnim etapem będzie izochoryczne rozprężenie gazu do p2 (proces 4-2), • skutek czego temperatura obniży się do 7).
Dla każdego z tych punktów można obliczyć wartości p, T i V z równania stanu gazu idealnego (2.9) - zob. tab. 3.1.
Tabela 3.1
|
Stan |
P [bar] |
V [dm3] |
T[ K] |
|
1 |
100 |
0,7436 |
298,15 |
|
2 |
120 |
0,6197 |
298,15 |
|
3 |
200 |
0,7436 |
569,3 |
|
4 |
200 |
0,6197 |
496,9 |
Wyszukiwarka
Podobne podstrony:
61950 skan0076 Termodynamika chemiczna 79 Tabela 3.4 T ln T CP [J • K- mor1] PU) [J • K"1 •
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0048 (2) Termodynamika chemiczna 51 Rys. 3.1. Praca izotermiczncgo rozprężania gazu Wstawiając w
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
więcej podobnych podstron