CCF20100422�009 (2)

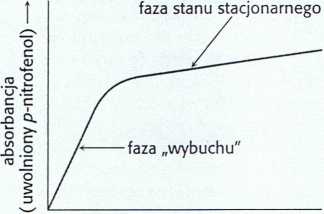
W warunkach stanu stacjonarnego hydroliza tego substratu zachodzi zgodnie z regułami kinetyki Michaelisa-Menten, a wyznaczone wartości JĆm i ^kat wynoszą odpowiednio 20 pM i 77 s_1. Fazę początkową reakcji badano z zastosowaniem metody zatrzymanego przepływu (ang. stopped-flow). Umożliwia ona szybkie zmieszanie enzymu i substratu oraz prawie natychmiastowe monitorowanie przebiegu reakcji. Na początku reakcji zastosowana metoda pozwala zaobserwować fazę „wybuchu”, czyli szybkiego uwalniania, w trakcie której bardzo szybko powstaje barwny produkt (rys. 9.4). Następnie, kiedy reakcja osiąga stan stacjonarny, produkcja związku barwnego zachodzi wolniej. Wyniki te wskazują, iż hydroliza przebiega w dwu etapach. Ponieważ dla badanego substratu pierwszy etap jest dużo szybszy niż drugi, pojawia się faza „wybuchu”.
Istnienie dwóch etapów reakcji to skutek powstania kowalencyjnie związanego produktu pośredniego enzym-substrat (rys. 9.5). Najpierw grupa acylowa substratu zostaje kowalencyjnie związana z enzymem w postaci p-nitrofenolanu (lub aminy, jeśli substrat jest amidem, a nie estrem), co prowadzi do powstania produktu pośredniego w postaci acyloenzymu. Następnie produkt pośredni - acyloenzym jest hydrolizowany, w rezultacie zostaje uwolniony składnik substratu mający postać kwasu karboksylowego, a enzym ulega regeneracji. Zatem każda cząsteczka enzymu produkuje bardzo szybko jedną cząsteczkę p-nitrofenolanu, czemu towarzyszy formowanie produktu pośredniego w postaci acyloenzymu. Jednak regeneracja enzymu przez hydrolizę tego produktu pośredniego zachodzi dużo wolniej, a pełen obrót enzymu wymaga obu etapów.
(A) (B)
|
/ OH + X—C |
acylacja |
/ 0—c |
deacylacja |
/? OH + HO—C / \ |
|
\ ’ |
-7-*• H20 | |||
|
/ R |
XH |
7 R |
7 R | |
|
XH = ROH (ester), RNH2 (amid) enzym |
acyloenzym |
enzym |
Rys. 9.5 Kataliza kowalencyjna. Hydroliza przez chymotrypsynę zachodzi w dwóch etapach: (A) acylacja prowadzi do powstania produktu pośredniego w postaci acyloenzymu, po czym (B) deacylacja umożliwia regenerację enzymu.
Seryna jest częścią triady katalitycznej, obejmującej również histydynę i kwas asparaginowy
Strukturę przestrzenną chymotrypsyny wyznaczył David Blow w roku 1967. Ogólnie, chymotrypsyna ma w przybliżeniu kształt kulisty i składa się z trzech łańcuchów polipeptydowych połączonych mostkami dwusiarczkowymi. Jest syntetyzowana jako pojedynczy polipeptyd nazywany chymotrypsynogenem, który jest aktywowany w drodze proteolizy prowadzącej do powstania trzech łańcuchów (s. 289). Miejsce aktywne chymotrypsyny, zawierające serynę 195, znajduje się w kieszeni zlokalizowanej na powierzchni enzymu (rys. 9.6). Analiza strukturalna pozwoliła uzyskać informacje na temat chemicznych podstaw wyjątkowej reaktywności seryny 195 (rys. 9.7). Łańcuch boczny seryny 195 jest połączony wiązaniem wodorowym z pierścieniem imida-zolowym histydyny 57. Z kolei grupa -NH pierścienia imidazolowego jest połączona wiązaniem wodorowym z grupą karboksylową asparaginianu 102. Ten układ reszt aminokwasowych nazywany jest triadą katalityczną. W jaki sposób przyczynia się ona do wysokiej reaktywności seryny 195? Reszta histydyny umożliwia odpowiednie ułożenie łańcucha bocznego seryny i polaryzację jej grupy hydroksylowej, która utrzymywana jest w stanie deprotonacji.
_245
9.1 Proteazy
milisekundy po zmieszaniu —*
Rys. 9.4 Kinetyka katalizy prowadzonej przez chymotrypsynę. W procesie rozcinania estru p-nitrofenylowego N-acetylo-L-fenyloaianiny przez chymotrypsynę wyraźnie widoczne są dwa etapy: faza gwałtownego „wybuchu” (stan przedstacjonarny) i faza stanu stacjonarnego.
Wyszukiwarka
Podobne podstrony:
zupełnym wymieszaniu reagentów w warunkach stanu stacjonarnego średnią szybkość reakcji można oblicz
43910 PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opis
PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opisuje uk
43910 PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opis
W diamagnetykach stacjonarne orbity torów Bohra będą zgodnie z regułą Lenza wytwarzać pole magnetycz
PC020609 [Uwzględnienie warunku k2 « k.t oraz zastosowanie I przybliżenia stanu stacjonarnego, prowa
PC020603 Obserwowany zanik stężenia substratu A w warunkach stanu pośredniego opisuje równanie jszyb
skan0228 Kinetyka chemiczna 231 W przybliżeniu stanu stacjonarnego mamy = ki[A]" - *2[L][A] + a
IMG293 ELLIOT ARONSON Jedynym układem warunków, po którym spodziewaliśmy1^ tego, że wytworzy dysonan
Sejsdef Ogniska wstrząsu - obszar górotworu, stanowiący źródło fal sejsmicznych. Wewnątrz tego obsza
IMAG0067 (6) UWODNIENIE 4. Uwodnienie / hydroliza! Rozpad minerałów zachodzi pod w
IMAG0249 (6) Parametry oceny równoważności biologicznej Ocena osiągnięcia stanu stacjonarnego Metody
IMGP0581 awdzenie warunku stanu granicznego no: podłoża -
Sprawdzenie warunku stanu granicznego nośności podłoża Warunek obliczeniowy Nr < m • Q{nb
więcej podobnych podstron