CCF20121217�003

Tablica 7.2. Cechy charakterystyczne adsorpcji i chemisorpcji
|
Adsorpcja fizyczna |
Chemisorpcja |
|
Ciepło adsorpcji jest mniejsze niż. ok. 40 kJ/moł. |
Ciepło adsorpcji jest większe niż ok. 80 kJ/mol. |
|
Adsorpcja zachodzi praktycznie tylko w temperaturze niższej od temperatury wrzenia adsorbatu. |
Adsorpcja może zachodzić w wysokiej temperaturze. |
|
Względny przyrost ilości zaadsorbowanego gazu zwiększa się z każdym kolejnym przyrostem jego ciśnienia względnego. |
Względny przyrost ilości zaadsorbowanego gazu zmniejsza się z każdym kolejnym przyrostem jego ciśnienia względnego. |
|
Wielkość adsorpcji zależy raczej od adsorbatu niż od adsorbentu. |
Wielkość adsorpcji jest charakterystyczna zarówno dla adsorbatu jak i dla adsorbentu. |
|
Proces adsorpcji nie jest związany z uchwytną pomiarowo energią aktywacji. |
Proces adsorpcji może być związany z energią aktywacji. |
|
Adsorpcja jest wielowarstwowa. |
Adsoipcj a j est j edno warstwo wa. |
7.4. IJKinetyka adsorpcji
Zależność równowagowa jest przedstawiona przez tzw. j izotermę adsorpcji^ W przypadku najprostszym na powierzchni adsorbentu tworzy się jednocząsteczkowa warstewka adsorbatu, którego cząsteczki nie oddziaływują na siebie. Kinetyka ta opisana jest równaniem
izotermy Langmuira
K 'CA
w =-!—^
2^.4
q 1 + Łc
gdzie
k\ i
k^ są parametrami zależnymi od .rodzaju adsorbentu^ i temperatury. Kinetyka zależności równowagowe] przedstawia ulość
cl
adsorbatu ,oraz od
zaadsorbowanej
substancji A, która pozostaje w równowadze ze stężeniem cj w roztworze.
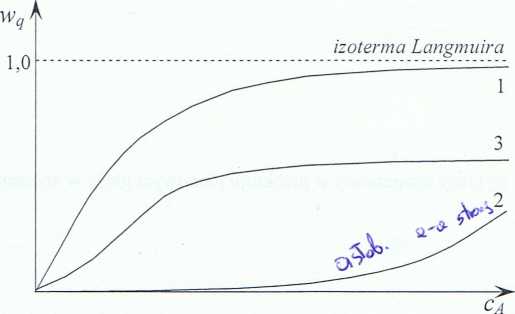
Rysunek 7.4 Izotermy adsorpcji: (1) adsorpcja silna i stosunkowo słabe oddziaływanie adsorbat-adsorbat, (2) adsorpcja słaba i stosunkowo silne oddziaływanie adsorbat-adsorbat. (3) przypadek pośredni.
Niektóre najczęściej używane izotermy stanu równowagi opisane są wzorami 1.1 - 1.4 w tablicy 7.3.
Zależność nierównowagowa opisuje; dynamikę procesu adsorpcji w procesie; dochodzenia do y j stanu równowagi.,Wzory 2.1 - 2.4 w~tablicy~7ł3 przedstawiają zależności nierównowagowe
66
Wyszukiwarka
Podobne podstrony:
u29 Tablica 24.1 Cechy charakterystyczne adsorpcji fizycznej i chemisorpcji Adsorpcja
CCF20110129�037 Tablica 6.13. Charakterystyczna absorpcja w podczerwieni grup funkcyjnyi li c/t
CCF20100620�011 tej cechy charakteryzuje ludzi pomocnych, skłonnych do wybaczania, jednostki o pogod
CCF20120620�001 6. Podaj 3 cechy, które charakteryzują prawidłowy węzeł chłonny: lO.i WcO0a -u
Uczciwek110 Tablica 25. Klasa ochron- ności Główne cechy charakterystyczne Warunki
24947 Uczciwek110 (3) Tablica 25. Klasa ochron- no.ści Główne cechy charakterystyczne Warunki
g Uzupełnianie słoneczka skojarzeniowego (cechy charakteru i ocena Harrego) SIEROT*^ MIŁY UCZYNNY
Image48 (3) KRÓTKI PRZEWODNIK PO GRAMATYCE JAPOŃSKIEJInformacje ogólne Cechy charakterystyczne język
WYBRANE ZAGADNIENIA RYNKU PRACY I 3 Rynek pracy i edukacja
więcej podobnych podstron