enzymy29

C5 - Regulacja aktywności enzymatycznej 123
C5 - Regulacja aktywności enzymatycznej 123

się zgodnie z modelem mieszanym, łączącym elementy modelu jedno-przejściowego i sekwencyjnego.
Poza tym enzymy allosteryczne mogą być kontrolowane przez cząsteczki efektorów (aktywatory i inhibitory), które wiążą się z enzymem w miejscu odmiennym od miejsca aktywnego (na tej samej podjednostce lub na innej podjednostce), powodując przez to zmianę konformaqi miejsca aktywnego, co zmienia szybkość działania enzymu (np. wiązanie CO2, H+ oraz 2,3-bisfosfoglicerynianu do hemoglobiny; patrz temat B4). Aktywator allosteryczny zwiększa aktywność enzymu, natomiast inhibitor al-losteryczny aktywność tę zmniejsza.
Karbamoilotransferaza asparaginianowa
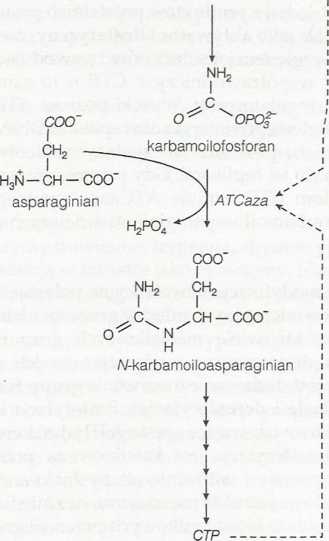
Karbamoilotransferaza asparaginianowa (transkarbamoilaza asparaginianowa; ATCaza), kluczowy enzym w biosyntezie pirymidyn (patrz temat FI) jest dobrym przykładem regulaqi allosterycznej. ATCaza katalizuje tworzenie N-karbamoiloasparaginianu z asparaginianu i karbamoi-lofosforanu, co jest decydującym etapem w biosyntezie pirymidyn {rys. 3). Związanie dwóch substratów, asparaginianu i karbamoilofosforanu jest kooperatywne, na co wskazuje sigmoidalna krzywa Vo jako funkcji stężenia substratu {rys. 4).
C02 + glutamina + ATP----t
aktywacja
inhibicja
Rys. 3. Powstawanie H-karbamoiioasparaginianu w wyniku działania karbamoilotransferazy asparaginianowej (ATCaza) jest decydującym etapem w biosyntezie pirymidyn i ważnym punktem kontroli

Wyszukiwarka
Podobne podstrony:
WYKŁAD 2 enzymy cz 1 (18) KINETYKA ENZYMATYCZNA Zajmuje się pomiarami ilościowymi szybkości reakc
enzymy27 CS - Regulacja aktywności enzymatycznej 121 prowadza decydujący etap szlaku metabolicznego,
WYKŁAD 2 enzymy cz 1 (25) AKTYWNOŚĆ ENZYMÓW MÓZE BYĆ REGULOWANACzynniki wpływające na szybkość re
77464 WYKŁAD 2 enzymy cz 1 (25) AKTYWNOŚĆ ENZYMÓW MÓZE BYĆ REGULOWANACzynniki wpływające na szybk
enzymy32 126 Regulacja syntezy i degradacji enzymów jiKcja D - Przeciwciała Układ Sekcja C
enzymy32 126 Regulacja syntezy i degradacji enzymów jiKcja D - Przeciwciała Układ Sekcja C
regularne jedzenie Wiele słyszy się o tym, że trzeba jeść regularnie, co ok 2,5-3h. Ale czy wiecie d
IMG 67 i Polit yka gospodarczo Według kryterium sposobu regulacji procesu gospodarczego wyróżnia się
470 A. ŻAK 2. STEROWANIE NEURONOWE 2.1. Regulator neuronowe W pracy proponuje się metodę sterowania
Stopień 2 - studia magisterskie Rok I / semestr 1 Zaliczenie zajęć odbywa się zgodnie z Regulaminem
WYKŁAD 2 enzymy cz 1 (54) AKTYWNOŚĆ ENZYMU I SPOSOBY JEJ WYRAŻANIA KATAL (kat) ilość enzymu katal
Reguła 7W nie odnosi się do: A B transportu ilości jl,.
Image (24) Praca w zespole Burza mózgów opiera się zaledwie na kilku prostych regułach. Kiedy zespół
str 6 (2) Włączanie i wyłączania odbiornika Włączanie i wyłączanie oraz regulacją siły głosu dokonu
więcej podobnych podstron