enzymy3

97
1 - Wprowadzenie do enzymów
w pewnych przypadkach przez odwracalne wiązania kowalencyjne. Po związaniu cząsteczki substratu i utworzeniu kompleksu enzym-substrat, katalitycznie czynne reszty w obrębie miejsca aktywnego enzymu działają na cząsteczkę substratu tak, aby przekształcić go początkowo w stan przejściowy (patrz temat C2), a następnie w produkt, który zostaje uwolniony do roztworu. Potem enzym, już wolny, może związać kolejną cząsteczkę substratu i rozpocząć nowy cykl katalityczny.
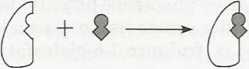
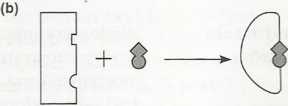
Zaproponowano dwa modele wyjaśniające, jak enzym może wiązać swój substrat. W modelu zamka i klucza, zaproponowanym przez Emila Fischera w 1894 roku, kształt substratu i miejsca aktywnego enzymu miałyby pasować do siebie jak klucz do zamka (rys. la). Oba kształty są uważane za sztywne i utrwalone oraz pasujące do siebie idealnie po odpowiednim zestawieniu. W modelu indukowanego dopasowania, zaproponowanym w 1958 roku przez Daniela E. Koshlanda, Jr, związanie substratu indukuje zmianę konformacyjną w miejscu aktywnym enzymu (rys. Ib). Poza tym enzym może zniekształcić substrat, wymuszając w nim konformaqę podobną do stanu przejściowego (patrz temat C2). Na przykład, związanie glukozy z heksokinazą indukuje taką konformacyjną zmianę w strukturze enzymu, że jego miejsce aktywne przyjmuje kształt komplementarny do substratu (glukozy) tylko po jego związaniu z enzymem. Różne enzymy wykazują cechy charakterystyczne dla obu modeli, a więc pewną komplementamość i pewne zmiany konformacji.
(a)
enzym substrat kompleks
enzym-substrat
enzym substrat kompleks
enzym-substrat
Rys. 1. Wiązanie substratu do enzymu, (a) Model klucza I zamka; (b) model indukowanego dopasowania
specyficzność
jbstratowa
Właściwości i ułożenie przestrzenne reszt aminokwasów tworzących miejsce aktywne enzymu determinują rodzaj cząsteczki, która może zostać związana i stać się substratem dla tego enzymu. O specyficzności substratowej często decydują zmiany stosunkowo niewielkiej liczby aminokwasów w miejscu aktywnym. Widać to wyraźnie w trzech enzymach trawiennych: trypsynie, chymotrypsynie i elastazie (patrz temat C5). Te trzy enzymy należą do rodziny enzymów o nazwie proteazy serynowe — „serynowe", ponieważ mają w miejscu aktywnym resztę seryny, której udział w katalizie jest krytyczny, a „proteazy", ponieważ katalizują hydrolizę wiązań peptydowych w białku. Te trzy enzymy rozszczepiają wiązania peptydowe w białkowych substratach po karboksylowej stronie pewnych reszt aminokwasów.
Trypsyna rozszczepia (tnie) po karboksylowej stronie dodatnio naładowanych reszt Lys lub Arg, chymotrypsyna — po karboksylowej stronie dużych reszt aminokwasów aromatycznych i hydrofobowych, a elastaza — po karboksylowej stronie reszt o krótkich, nienaładowanych łańcuchach bocznych. Różna specyficzność tych enzymów jest narzucona przez
Wyszukiwarka
Podobne podstrony:
enzymy9 SI - Wprowadzenie do enzymów 103 Tak więc wzór izoenzymów jest charakterystyczny dla dare; t
enzymy5 - Wprowadzenie do enzymów 99 :ela 1. Międzynarodowa klasyfikacja enzymów Nazwa Typ kataliz
HPIM0790 4- Wprowadzenie do kinematyki robotów - w przypadku ruchów obrotowych (A, B,C) w kierunku p
48730 IMAG0876 Wprowadzenie do obrobki plastycznej W przypadku złożonych stanów naprężenia warunek p
Wprowadzenie do sprawozdania finansowego W przypadku sporządzenia sprawozdania finansowego zgodnego
66050 P1080220 4. Wprowadzenie do kinematyki robotów - w przypadku ruchów obrotowych (A, B, C) w kie
więcej podobnych podstron