Materiały tif
WYKŁAD 2: Użytkowe właściwości materiałów - nadprzewodnictwo.
NADPRZEWODNICTWO - cecha przewodnika elektrycznego, polegająca na tym, że w pewnych warunkach ma on zerową rezystancję(zanikanie oporu prądu elektrycznego). Innymi ważnymi zjawiskami zachodzącymi w nadprzewodnikach są: wypychanie pola magnetycznego (efekt Meissnera) oraz kwantowanie strumienia magnetycznego przechodzącego przez nadprzewodzącą pętlę. Zjawisko to zachodzi w określonych warunkach oraz w określonych rodzajach przewodników.
Należy zwrócić uwagę, że zerowa oporność elektryczna nie wystarczy do zdefiniowania nadprzewodnictwa. Co więcej, w stanie nadprzewodnictwa opór elektryczny dla elektronow(ale nie dla par Coopera) jest nadal niezerowy. Poprawne określenie oparte jest na doskonałym diamagnetyzmie materiałów nadprzewodzących(zwanym efektem Meissnera).
Zgodnie z prawem Ohma, podczas przepływu prądu elektrycznego przez przewodnik na przewodniku powstaje pewien spadek napięcia, a z powodu niezerowego oporu elektrycznego wydziela się energia w postaci ciepła.
TEMPERATURA KRYTYCZNA - temperatura, powyżej której zanika różnica gęstości między stanem gazowym a ciekłym danej substancji, a w związku z tym niemożliwe jest skroplenie gazu pomimo wzrostu ciśnienia. Mówi się, że taka substancja znajduje się w stanie nadkrytycznym.
Historia nadprzewodnictwa:
• 1911 r. H. K. Onnes obserwuje zanik oporu elektrycznego i nazywa je nadprzewodnictwem powstającym poniżej temperatury krytycznej;
• 1912 r. H. K. Onnes obserwuje, że pole magnetyczne większe od pola magnetycznego krytycznego Hc niszczy nadprzewodnictwo;
• 1933 r. odkrycie, że pole magnetyczne jest wypychane z nadprzewodnika;
• 1935 r. Fritz i Heinz stworzyli fenomenologiczny model tłumaczący efekt Meissnera;
• 1950 r. Ginzburg i Landan stworzyli fenomenalną teorię;
• 1957 r. Bardeen stworzył teorię BCS;
• 1986 r. Bednarz i Muller odkryli nadprzewodnictwo w ceramicznych materiałach LaBaCuO.
Rozróżnia się dwa zasadnicze rodzaje nadprzewodnictwa:
• nadprzewodnictwo niskotemperaturowe - odkryte przez Kamerlingha-Onnesa (Nagroda Nobla w 1913) dla rtęci. Występuje w temperaturach poniżej 30 K, dla czystych metali i stopów metalicznych będących w większości nadprzewodnikami I-go rodzaju. Nadprzewodnictwo to jest dobrze opisywane przez teorię BCS.
• nadprzewodnictwo wysokotemperaturowe - przedstawione przez Bednorza i Mullera w 1986 roku. Występuje w temperaturze powyżej 30 stopni K, ten typ nadprzewodnictwa wykazują materiały tlenkowe o charakterze ceramik i będące nadprzewodnikami Ii-go rodzaju. Na razie nie ma teorii wyjaśniającej to zjawisko.
Zalety nadprzewodnictwa:
- brak oporu podczas przepływu prądu;
- niemal nieograniczone czerpanie energii elektrycznej z przepływu prądu;
- bezstratność energii elektrycznej na energię ciepła;
- prąd wzbudzony w nadprzewodniku płynie w nim nawet po odłączeniu jego zewnętrznego źródła.
Wady nadprzewodnictwa:
- konieczność utrzymywania odpowiednio niskiej temperatury;
- koszt chłodzenia nadprzewodników;
- ograniczona możliwość wykorzystania ich przemysłowo;
- dość kruche i łatwo ulegające zniszczeniom(ceramiczne).
Zastosowania:
• budowa silnych magnesów i elektromagnesów nadprzewodzących, w których prąd elektryczny porusza się niemal dowolnie długo. Pociąga to za sobą szanse na wytwarzanie bardzo dużych pól magnetycznych. Główne zastosowania praktyczne to w tym przypadku głównie akceleratory;
• konstruowanie wydajnych systemów analitycznych, znajdujących zastosowanie m.in. w chemii, biologii i medycynie (np. mechanizm rezonansu jądrowego);
• produkcja bardzo pojemnych pamięci komputerowych i elektronicznych;
• wytwarzanie aparatury przydatnej w przeprowadzaniu procesu elektrolizy - istotne w procesach o technologiach chemicznych;
• budowa przewodów oraz kabli służących do wydajnego, bezstratnego transportu prądu;
• synchrotron elektronowy - w fizyce doświadczalnej jądrowej i cząsteczkowej, zastosowanie w akceleratorach kołowych (cyklotron, betatron). Użycie nadprzewodnika zapewnia tu uzyskanie silniejszych pól magnetycznych służących do rozpędzania wiązek cząstek w akceleratorze, a zatem pomaga nadać im wielkie energie i prędkości. U.elk. SJewa. HclJi-ouókj (La^e Hadron CotLder)
~ <~kjszy Ad dfz>/'ec/<e cdcceleya.ioz cz^siela. <-> £cń kthl)
OdrodkiA OcAc/aAj ęJ&tdtOłOych Kicx. iereKj.e Fy&h)cj'i'/•Szsziajćct
WYKŁAD 3: Kryształy i metale o strukturze krystalicznej.
SZKŁO METALICZNE - stop amorficzny(bezpostaciowy) dwu- lub wieloskładnikowy, w którym składnikiem podstawowym jest metal. Otrzymywane najczęściej w wyniku przechłodzenia ciekłego stopu przy szybkości chłodzenia uniemożliwiającej zarodkowanie i wzrost krystalitów (zwykle 106—104 K/s); materiały te cechuje duża twardość, wytrzymałość, plastyczność, sprężystość, odporność na
korozję wżerową oraz duży opór elektryczny.
Ciekły stop dostarczany pod ciśnieniem
Dysza
prostokątną
Jeziorko stopionego .
-Jutu Amorficzną taśma
stopo o grubości r ił) utn
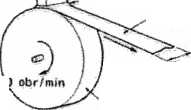
*2000 obr/mm
Maksymalna szerokość łOOmm
Bęben miedziany chłodzony woda o średnicy I SO mm
^ Kształt bębna do odlewania drutu
Właściwości szkła metalicznego:
- elastyczność dziesięciokrotnie większa niż w stopach metali;
- dwukrotnie większa twardość w porównaniu do stali;
- trzykrotnie większa odporność na odkształcenie trwałe niż metale;
- odporność na korozję;
- małe straty przy przemagnetyzowaniu;
- nadprzewodnictwo.
Zastosowanie szkła metalicznego:
• rdzenie transformatorów;
• głowice magnetyczne;
• elastyczne ekrany magnetyczne;
• ostrza, instrumenty medyczne;
• węże, rury, pasy;
implanty ortopedyczne;
sprzęt sportowy(narty, kije golfowe, rakiety tenisowe).
WYKŁAD 4: Metalurgia.
METALURGIA - nauka o metalach obejmująca m.in. przeróbkę plastyczną, odlewnictwo, metaloznawstwo i metalurgię ekstrakcyjną. Przedmiotem badań metalurgii jest przeróbka rud metali aż do produktu końcowego (np. kabel miedziany, drzwi samochodowe, profile aluminiowe). W języku potocznym utożsamiana jest często z hutnictwem, przy czym hutnictwo zajmuje się wyłącznie metalurgią ekstrakcyjną.
• metalurgia klasyczna - zajmuje się głównie związkami żelaza, stali;
• metalurgia chemiczna - wyodrębnienie metali rzadkich i szlachetnych.
Metale nieżelazne: Cu, Ni, Co, Zn, Cr, Al, Mg.
Metale rzadkie: Li, Rb, Cs, Ti, Zr, Hf, V, Nb, Ta, Mo, W, Re, In, Tl, Ga.
Metale szlachetne: Ag, Au, Pt.
PIROMETALURGIA - dział metalurgii zajmujący się otrzymywaniem metali przy wysokich temperaturach. Pirometalurgia obejmuje procesy spiekania, redukcji tlenków metali oraz utleniania (świeżenia). Stosowana jest w przemyśle miedziowym.
Wzrost temperatury powoduje przyspieszenie zachodzących reakcji. Środowisko: powietrze, gazy redukujące i utleniające, gazy reaktywne(chelowce), gazy szlachetne, próżnia.
1. Proces szybowy w piecu szybowym, 1200°C, brykiet(lepiszcze), koks, żużel konwertowy:
STREFA 1: CuFeS2 -* CuS + FeS; Cu3FeS4 -»> 2CuS + CuS + FeS
STREFA 2: 2CuS2 -> 2CuS + 2S; 4CuFeS2 -> 2CuS + 4FeS + 2S; 4Cu5FeS4 -> 10Cu2S + 4FeS + 2S
2. Konwertory, 1200-1300°C:
a) usuwanie żelaza(utlenianie wobec Si02): 2FeS + 302 + Si02 —> Fe2Si04(żużel) + 2S02;
b) utlenianie siarki: Cu2S + 02 —* 2Cu + S02;
c) proces zawiesinowy - pylisty koncentrat, powietrze wzbogacone w tlen.
METALURGIA PROSZKÓW - dział metalurgii zajmujący się wytwarzaniem proszków metali oraz przedmiotów z tyusch proszków (spiek). Głównymi procesami metalurgii proszków są: wytwarzanie proszków, zagęszczanie (zwykłe przez prasowanie w formach) i spiekanie (w temperaturze niższej od temperatury topnienia metali wyjściowych). Metoda wytwarzania metali z ich proszków, bez przechodzenia przez stan ciekły.
HYDROMETALURGIA - dział metalurgii zajmujący się otrzymywaniem metali z rud, koncentratów i innych surowców na drodze ługowania wodnymi roztworami odpowiednio dobranych związków chemicznych. Z wodnych roztworów po ługowaniu wydziela się metale za pomocą wytrącania nierozpuszczalnych związków, elektrolizy, ekstrakcji rozpuszczalnikowej, wymiany jonowej, cementacji, sorpcji na węglach aktywnych lub redukcji wodorem. Metody hydrometalurgii znajdują zastosowanie w metalurgii metali rzadkich, szlachetnych i nieżelaznych. Wydobywanie metali z rud półproduktów, koncentratów i odpadów przemysłowych zawierających metale, przy zastosowaniu wodnych roztworów wybranych odczynników chemicznych i następnym wydzieleniu rozpuszczonych metali w celu otrzymania ich w czystej postaci.
Zalety:
• selektywność, duża skuteczność w stosunku do surowców niewzbogaconych;
• niska temperatura;
• wysoki stopień wydzielania metali użytecznych z surowca;
• kompleksowość;
• efektywność ekonomiczna po wprowadzeniu bezfiltracyjnych schematów technologicznych;
• eliminacja zagrożeń środowiska naturalnego;
• mała „wrażliwość” na zmiany składu surowca.
Wady:
• wymóg wysokiej kultury technicznej personelu;
• względnie mała szybkość procesu;
• gospodarka wodno-ściekowa;
• zagospodarowanie stałych odpadów;
• toksyczność niektórych reagentów;
• konieczność wysokiej odporności urządzeń na korozję ze względu na agresywność stosowanych środowisk.
BIOMETALURGIA - wykorzystanie mikroorganizmów (bakterie, grzyby) w procesach tworzenia i koncentrowania (biokumulacja) metali.
ELEKTROMETALURGIA - dział metalurgii zajmujący się otrzymywaniem, oczyszczaniem i przetwarzaniem metali i ich stopów przy pomocy energii elektrycznej. Procesy elektrometalurgii przeprowadza się za pomocą elektrolizy lub wykorzystując piece elektryczne.
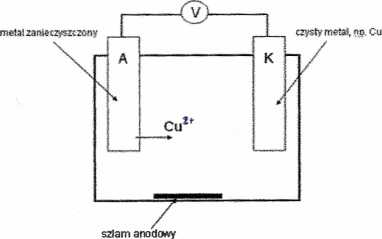
Etapy metalurgii:
■ przygotowywanie rudy, obejmujące wzbogacanie (np. grawitacyjne, ogniowe, magnetyczne, przez flotację),
■ właściwe otrzymywanie metali (na drodze suchej - pirometalurgia lub na drodze mokrej - hydrometalurgia),
* rafinacja metali,
■ otrzymywanie stopów,
■ obróbka termiczna (np. hartowanie), ■ odlewnictwo,
■ obróbka plastyczna (np. walcowanie),
■ obróbka powierzchniowa (np. cyjanowanie).
Przygotowanie surowca: mechaniczne (rozdrobnienie i klasyfikacja, wzbogacanie) i chemicznie (prażenie -utleniające, redukujące, nasiarczające, chlorujące oraz spiekanie).
ŁUGOWANIE - proces transportu masy z fazy stałej do fazy ciekłej. Mówiąc prościej, jest to wypłukiwanie danej substancji z fazy stałej za pomocą cieczy. W metalurgii jest to etap na drodze otrzymywania metalu w procesie hydrometalurgicznym. W górnictwie jest to fizyczny sposób urabiania, który polega na upłynnianiu skały bez powodowania zmian chemicznych. Przez ługowanie pozyskuje się sól kamienną i chlorek potasu.
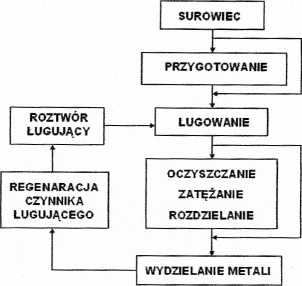
Metody ługowania:
ŁUGOWANIE PERKOLACYJNE
1. Ługowanie w złożu „in situ” - wprowadza się roztwór ługu do złoża poprzez wwiert w innym miejscu roztworu związku ługu i metalu wprowadzonym;
2. Ługowanie na hałdzie - materiał w postaci hałd układa się na nieprzepuszczalnym podłożu i zrasza się go roztworem ługującym;
, wylewa się na to ług i czeka aż nim
3. Ługowanie w kadziach - wkłada się warstwy rudy w postaci „komina” przesiąknie.
ŁUGOWANIE Z MIESZANIEM
1. Ługowanie w zawiesinie;
2. Ługowanie ciśnieniowe;
3. Spiekanie ługujące.
Oczyszczanie roztworu po ługowaniu:
• wytrącanie jonów - związki metali: Fe, U, Th, Be, Cu, Co;
• krystalizacja - związki metali: AL, Cu, Ni, Mo, W;
• redukcja gazami - metale, związki metali: Cu, Ni, Ag, Mo, U;
• redukcja elektrolityczna - metale zanieczyszczone: Au, Ag, Cu, Ni, Co, Zn;
• redukcja elektrochemiczna - czyste metale: Au, Ag, Cu, Cd.
EKSTRAKCJA ROZPUSZCZALNIKOWA - należy do jednej z metod rekultywacji gleb. Często stosowana z innymi technologiami remediacji. metoda pozwala na szybkie i całkowite oczyszczenie gleb z silnie zanieczyszczonymi związkami organicznymi. Metoda ta charakteryzuje się również dużą inwazyjnością w stosunku do środowiska. Przenoszenie metali z roztworów wodnych do fazy organicznej, a następnie przeniesienie roztworu ekstrahowanego metalu do innej fazy wodnej. Zastosowanie: wydzielanie metali z roztworów rozcieńczonych przy ich jednoczesnym oddzieleniu, by otrzymać roztwór bardziej stężony; oddzielanie roztworów metali o podobnych właściwościach fizykochemicznych.
Pierwotna faza organiczna - roztwór ekstrahenta w rozpuszczalniku.
Równowaga ekstrakcji: Men+(W) + nHR(0) <-» MeRn(0) + nH+(w)
WYKŁAD 13: Materiały promienioczułe.
INFORMACJA OBRAZOWA - informacja docierająca do osobnika z odpowiednio wykształconym zmysłem wzroku, którą tworzą pola obrazu optycznego różniące się kontrastem jasności (luminacji) i/lub kontrastem barwowym. Analiza tego obrazu pozwala na powstanie wyobrażenia przedmiocie, zobrazowania go i uświadomienie treści informacji.
Obrazownie jest współczesnym określaniem dotyczącym zapisu obrazu, który odbywa się w oparciu o światło lub inne zakresy promieniowania elektromagnetycznego, oddziaływujące na materiały promienioczułe, które ulegają pewnym specyficznym przemianom, co umożliwia zapis przekazywanej informacji obrazowej.
ŚWIATŁO potocznie nazywa się tak widzialną część promieniowania elektromagnetycznego, czyli promieniowanie widzialne odbierane przez siatkówkę oka ludzkiego np.w określeniu światłocień. Dzięki niemu możemy dostrzegać i różnicować przedmioty, ich wielość, kształt, barwę i ruch.
Ogólnie informacje obrazową możemy podzielić na dwa rodzaje:
• komercyjną - obejmującą obrazy artystyczne, amatorskie, reporterskie, a więc takie które ukazują ludzi, przejawy ich życia, przyrodę, zwierzęta, krajobraz itp.;
• naukowo-techniczną - której zadaniem jest przekazanie informacji technicznej lub naukowej o przedmiocie lub zarejestrowanym zjawisku, właściwości materii itp. Przykłady: fotografia mikroskopowa, rentgenowska, astronomiczna, w podczerwieni, w ultrafiolecie, rejestrująca promienie gamma.
Wszystkie obrazy, które powstają w wyniku obrazowania dzielimy na:
1. negatywowe - wartości jasności (tonów) są odwrotne niż zarejestrowane w oryginale;
2. pozytywowe - wartości tonalne odpowiadaj ą oryginałowi.
Z punktu widzenia ich struktury:
1. płaskie i reliefowe;
2. wielotonalne (półtonowe) i punktowe.
Wszystkie rodzaje materiałów , które znajdują zastosowanie w procesie obrazowania dzieli się na dwie kategorie: materiały zdjęciowe i materiały reprodukcyjne.
Z punktu widzenia stosowanych materiałów promienioczułych system obrazowania dzielimy na:
a) oparte na zjawiskach fotochemicznych:
• fotografia srebrowa (tradycyjna) wykorzystująca światłoczułość soli srebra;
• fotografia bezsrebrowa, wykorzystująca promienioczułość związków organicznych i nieorganicznych.
b) oparte na zjawiskach fotofizycznych:
• elektrofotografia, elektrostatyczne systemy, w których rolę materiału promienioczułego spełniają fotopółprzewodniki nieorganiczne i organiczne;
• magnetyczny zapis obrazu, w których wykorzystuje się zmiany pola magnetycznego;
c) oparte na technologiach elektronicznych:
• fotografia cyfrowa, w której rolę materiały światłoczułego spełniają elektroniczne detektory typu CCD lub CMOS w postaci scalonej prostokątnej matrycy miniaturowych elementów półprzewodnikowych.
FOTOCHEMIA - dział chemii zajmujący się reakcjami, które zachodzą pod wpływem działania promieniowania elektromagnetycznego.
Prawo Grotthusa - Drapera: przemiany fotochemiczne wywołuje ta część promieniowania świetlnego, która ulega pochłonięciu przez reagujący układ (na przebieg reakcji nie ma wpływu promieniowanie odbite).
Prawo Einsteina: pojedynczy zaabsorbowany foton wywołuje jeden akt reakcji fizycznej lub chemicznej. Prawo to nie dotyczy układów w których zachodzą reakcje wtórne (np. reakcje łańcuchowe).
Zapis informacji składa się z trzech operacji: REJESTRACJA —» WIZUALIZACJA —> STABILIZACJA
Typy reakcji pierwotnych:
• Fotoliza, podczas której jedna substancja rozpada się pod wpływem promieniowania na dwie lub więcej substancji o odmiennych lub wyjściowych własnościach fizykochemicznych;
• Fotoindukowane przegrupowanie, które prowadzi do zmian w obrębie jednej cząsteczki związku fotoczułego bez zmiany składu sumarycznego;
• Reakcje fotosubstancji polegające na wymuszaniu przez absorbcję promieniowania elektromagnetycznego chemicznej reaktywności substancji naświetlanej;
• Reakcje fotoaddycji polegające na fotoindukowanej syntezie nowej chemicznie substancji z dwóch zawartych w warstwie fotoczułej substratów;
• Reakcje fotoredoks, które zachodzą w wyniku foto indukowanego przeniesienia fotoelektronu z cząsteczki będącej jego donorem na akceptor.
Rodzaj energii działającej stabilizująco (utrwalanie): chemiczna, cieplna, elektroniczna, elektromagnetyczna. Reakcja fotochemiczna w czystym krysztale AgHal:
1. sumaryczna reakcja fotochemiczna: AgBr + hv —> Ag0 + Br;
2. pochłonięty kwant promieniowania wyzwala elektron z jony bromkowego: Br' + hv —> Br0 + e';
3. wyzwolony elektron wędruje w siatce krystalicznej i łączy się z jonem srebra: Ag+ + e’ —> Ag0, neutralizując go w wyniku czego powstaje atom srebra;
4. powstające pojedyncze atomy Br łączą się parami w cząsteczki Br2 i opuszczają kryształ.
Wywoływanie jest to proces przemiany utajonego obrazu fotograficznego w srebrowy obraz widzialny, polega na redukcji naświetlonych kryształów halogenków srebra warstwy światłoczułej do srebra metalicznego tworzącego widoczny obraz, wg reakcji: Ag' + Red Ag + Ox + H+
Wyszukiwarka
Podobne podstrony:
ScannedImage 19 • # r: Nadprzewodnictwo o Cecha przewodnika elektrycznego , polegająca na tym, że w
ScannedImage 19 • # r: Nadprzewodnictwo o Cecha przewodnika elektrycznego , polegająca na tym, że w
Img00131 135 W przewodach z użyciem Nb3Sn jako materiału nadprzewodzącego, jedynie niewielka część p
Img00132 136 Materiały nadprzewodzące wykonuje się z nich przez naniesienie cienkich warstw tlenków
Nauka o Materiałach r- Wykład XII Właściwości elektryczne Jerzy Lis
Img00129 133Nadprzewodniki II rodzaju 2.87. Materiały nadprzewodzące, którymi dysp
i procesach rzutujących na jakość i wartość użytkową, o właściwym ukształtowaniu jakości wyrobów w
Programowanie Równoległe i Rozproszone Wykład 5 Rodzaje właściwości niezbędnych do rozwoju systemu
więcej podobnych podstron