2009 01 01 3844

G W v.til $. I. IXil'ty (Am(f voAr»nU \ttr- -ISBN 9?*4>4M5324'.1.0 by W PW SHrt
5. Chemia troposfery — opad atmosferyczny
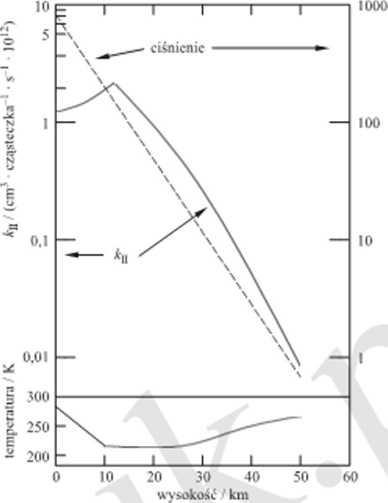
Rys. 5.1. Zmiany stałej szybkości reakcji drugiego rzędu tworzenia się HOSO; w zależności od wysokości w troposferze i slralosfcrzc (Przedrukowane z pracy: J.G. Calvcrt. W.R. Stockwcll. „Mcchanism and rates of the gas-phasc ożidations of sulfur dioxidc and nitrogen oxides in tlie atniosphere”. w Acidic deposilion: sulfur and nilrogen oxides (red. A.H. Lcggc. S V Krupa). Lewis PublLshcrs Inc.. Chelsea.
Michigan 1990 |
126
ulegać zmniejszeniu wraz ze zmniejszaniem się ciśnienia wraz z wysokością w troposferze i stratosferze. Jednakże przy określaniu stałej szybkości należy uwzględnić drugi czynnik. Podobnie jak w wielu innych reakcjach typu rodnik-rodnik oraz jon-cząstcczka energia aktywacji tej reakcji asocjacji ma wartość ujemną. Dlatego te/ obniżeniu temperatury' wraz z wysokością w troposferze powinien odpowiadać wzrost stałej szybkości reakcji. Połączony wpływ temperatury i ciśnienia na stałą szybkości reakcji drugiego rzędu przedstawiono na rys. 5.1.
Rodnik HOSO; może wówczas ulegać licznym i względnie szybkim reakcjom prowadzącym do powstania kwasu siarkowego!VI). Najprostszym i najważniejszym procesem. w którym tworzy się kwas. jest
H0S02 + 02 + M -*• HOO* + S03 + M (5.22)
7. kolei w wyniku rozpuszczania się iritlcnku siarki w wodzie tworzy się kwas siarkowymi).
SO.i + H:0 H2SOa
(5.23)
Wyszukiwarka
Podobne podstrony:
2009 01 01 4355 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 5.
2009 01 01 3943 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 5.
2009 01 01 0210 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 2
2009 01 01 0328 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 6
2009 01 01 1443 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 3.
2009 01 01 1511 G W v.til $. I. IXil ty (Am(f voAr»nU tr- -ISBN 9?*4>4M5324 .1.0 by W PW SHi? 3.
więcej podobnych podstron