Image16 (30)

121 Rozw iązania zadań ze zbioru "MENDLA "
1 m3 • 300 kPa
3^r~
PB = 100 kPa
/.Is
Vc
Z równania gazu doskonałego dla stanów B i C otrzymamy: PB • Vb pc • Vc Tb ” Tc
PC =
stąd pc =
PB • Vb • Tę Tb • Vc
Z wykresu odczytamy:
Pb = 100 kPa , Vb = 3 m3
Tc = 150 K" , TB = 100K, Vc = 4/rr3
100 kPa -3 m3-150 K 100 K ■ 4 m3 pc = 112,5 kPa
Ze stanu C do D gaz przechodzi izochorycznie (V = const.), więc rysujemy prostą przechodzącą przez początek układu i punkt C. Zaznaczamy odcinek CD.
Ze stanu A do D można gaz przeprowadzić izobarycznie, więc:
Pa = po-
Odp.: Przemiany z wykresu V(T) pokazano w układzie p(T) na wykresie nr II.
Zadanie 627 str.126
Jeżeli gaz jest sprężany od objętości Vi do V2 w naczyniu nieprzewodzącym ciepła, to mamy przemianę adiabatyczną.
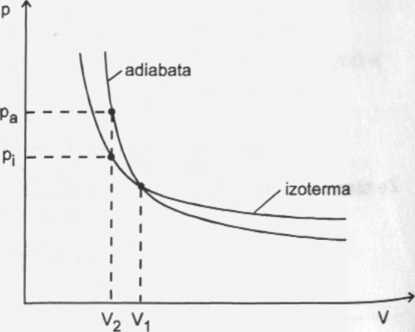
Na podanym wykresie możemy porównać ciśnienia gazu po sprężeniu od objętości Vi do V2 dla obu przemian.
Przy sprężaniu izotermi-cznym gazu przyrost ciśnienia jest mniejszy niż przy spężaniu adiabatycznym. Dla V2 mamy pa > Pi.
Przy sprężaniu izotermi-cznym pi Vi = p2 V2 za zwiększenie ciśnienia jest odpowiedzialne zmniejszenie się objętości. Natomiast w wyniku sprężania
adiabatycznego zmniejsza się objętość i jednocześnie rośnie temperatura, a więc przy-^st ciśnienia w tej przemianie jest większy, co wypływa bezpośrednio z równania stanu gazu:
n . \/
p-V
= n
p =
n-R-T
Szukane:
t3 = ?
V(T) = ? P(V) = ?
Ti =T2 - przemiana izotermiczna P3 = p2 - przemiana izobaryczna
W stanie początkowym gaz ma parametry:
pi = 100/cPa, Vi = 10 dm3 oraz Ti=283 K W wyniku przemiany izotermicznej gaz osiągnął stan 2 o parametrach: T2 = Ti = 282 K oraz V2 = 5 dm3 Dla tej przemiany zachodzi związek:
Pi • Vi = p2 • V2 /: V2
pi • Vi
P2 =
P2 =
V2
100 /cPa
10 drrP
5 dm3 P2 = 200 kPa
Ze stanu 2 do trzeciego gaz przeprowadzono izobarycznie, więc jego parametry mają wartość:
p3 = p2 = 200 kPa oraz Dla przemiany izobarycznej mamy:
V2 V3
V3 = 10 dm3
Ta T3
T3 • V2 = T2
t2-v3
T3 =
T3 =
V3 /: V2
5 dm3 T3 = 566 K
Wyszukiwarka
Podobne podstrony:
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
49379 Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
47352 Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamik
Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamiki Zada
Image40 (22) 167 Rozw iązania zadań ze zbioru "MENDLA" 167 Rozw iązania zadań ze zbioru
Image6 (48) 102 Rozw iązania zadań ze zbioru "MENDLA " Tb = 20kPa■300K 10 kPa Tb = 600K Od
47352 Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamik
Image2 (74) 58 Rozw iązania zadań ze zbioru "MENDLAZadanie 575 str.115 Dane: n = 0,5 molaSzukan
Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamiki Zada
więcej podobnych podstron