47352 Image44 (17)

175 Rozw iązania zadań ze zbioru "MENDLA
Pierwsza i druga zasada termodynamiki Zadanie 681 str.135
Dane:
Szukane:
Q
30 kJ- (najprawdopodobniej 30 kJ AT = ?
a nie 50 kJ, jak podano w zbiorze).
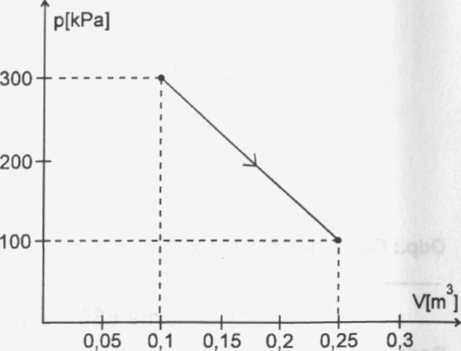
Pi
P2
V1 V2
300 kPa = 300000 Pa 100 kPa = 100000 Pa 0,1 m3 0,25 rri3
Zgodnie z I zasadą termodynamiki AU = W + Q, gdzie W = - p • AV
Ciśnienie zmienia się liniowo, więc weźmiemy pod uwagę ciśnienie średnie: Pśr = fil|-^,aAV = V2-V,
Po podstawieniu do pracy W mamy:
w = _£L|P2.(V2_V1)
W = - ^OOOOPa+IOOOOOPa (Q^_Q^}
W = - 200000Pa • 0,15/rr3 , Pa = -^
nr
W = - 30000-^ • m3 , N-m=J
nr
w = - 30 kJ
Gaz wykonał pracę 30kJ, więc możemy obliczyć jego energię wewnętrzną. AU = - 30kJ + 30kJ = 0
__Rozwiązania zadań ze zbioru "MENDLA"_176
Energia wewnętrzna AU gazu nie zmieniła się , więc jego temperatura również nie ulega zmianie, czyli AT = 0
Odp.: Temperatura gazu nie uległa zmianie.
Zadanie 682 str.135
Szukane:
cp = ? - ciepło właściwe przy stałym ciśnieniu cv = ? - ciepło właściwe przy stałej objętości
K • mol
K =
A Cv , gdzie
Cp - ciepło molowe przy stałym ciśnieniu Cv - ciepło molowe przy stałej objętości
Cp — Cv • K
Z definicji ciepła molowego otrzymamy:
c„__Qe_
Cp n • AT
Podstawimy do Cp = k • Cv
Qd Qv
stąd
= K
/•n
Cv =
n • AT
n • AT n • AT Teraz obie strony równania podzielimy przez m.
gdzie n - ilość moli gazu
up Qv AT = K ' AT
Q
/: m
gdzie
m - masa gazu
= K
m • AT m-AT’
lecz z definicji ciepła właściwego wiadomo, że
Cv =
Qv
cp =
m • AT
Więc po podstawieniu mamy:
Cp — K • Cv
Z równania Mayera otrzymamy:
Cp = R + Cv
Za Cp i Cv podstawimy odpowiednie wzory,
m-AT*
stąd
Q
Qv
/• n
n • AT n • AT Teraz obustronnie dzielimy przez masę m gazu.
'2 — Zeszył 5
Wyszukiwarka
Podobne podstrony:
47352 Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamik
Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamiki Zada
Image44 (17) 175 Rozw iązania zadań ze zbioru "MENDLAPierwsza i druga zasada termodynamiki Zada
Image40 (22) 167 Rozw iązania zadań ze zbioru "MENDLA" 167 Rozw iązania zadań ze zbioru
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
Image6 (48) 102 Rozw iązania zadań ze zbioru "MENDLA " Tb = 20kPa■300K 10 kPa Tb = 600K Od
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Image2 (74) 58 Rozw iązania zadań ze zbioru "MENDLAZadanie 575 str.115 Dane: n = 0,5 molaSzukan
49379 Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "
Image1 (91) 56 Rozw iązania zadań ze zbioru "MENDLA 56 Rozw iązania zadań ze zbioru "MENDL
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
Image16 (30) 121 Rozw iązania zadań ze zbioru "MENDLA " 1 m3 • 300 kPa 3^r~ PB = 100 kPa /
więcej podobnych podstron