skan0284

287
Elektrochemia
Jeśli zapisać E°(T) = a0 + axT + a2T2 + a2T3, to (dE°\
\~w)p = a'+2aiT+^T =
= 2,6967 • 1(T3 - 1,6460 • 10-5r + 1,7607 • 10-8 T2 [V • K-1].
W temperaturze 25°C (dE°ldT)p = -6,4566 • 10“4 V • K-1, zatem w tej temperaturze
AS° = -1 • 96485 • 6,4566 • 10-4 = -62,30 J • K-1 • mol"1.
Entalpię reakcji ogniwa opisuje równanie (6.53)
AH° = nF
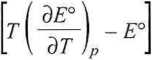
= nF (-a o + a2T 2 + 2 a2 T 3).
W 25°C AH° = 1 • 96485 [298,15 • (-6,4566 • lO^4) - 0,2224] • 10-3 = -40,03 kJ • moE1.
Zgodnie z (3.9)
ACp = = nF(2a2 + 6a3T)T,
zatem w 298,15 K. dla reakcji ogniwa
ACp = 1 • 96485 (-1,6460 • 10-5 + 3,5214 • 10-8 • 298,15) • 298,15 =
= -171,5 J • K-1 • mol-1.
Zgodnie z reakcją ogniwa
AG° = AG°(Ag) + AG°(H+) + AG°(Cl~) -jAG°(H2) - AG°(AgCl).
Według obowiązującej konwencji IUPAC AG298 (Ag) = 0; AG29iS (H2) = 0. Obliczenie wartości standardowych funkcji tworzenia jonów wymagało przyjęcia, że zmiany tych funkcji dla reakcji tworzenia kationu wodom w rozcieńczeniu nieskończenie wielkim
i H2(g) —> Haq + e
są równe zeru: zlG2°98 (Hjq) = 0, AH?98 (Hjq) = 0, S?9$ (H^) = 0.
zJG°(AgCl), zmianę standardowej entalpii swobodnej reakcji tworzenia AgCl w 298,15 K,
Ag + + C12 = AgCl obliczymy zgodnie z równaniem
AG° = AH° - TAS° = -126,8 - 298,15 • 10-3 (96,07- +223,0-42,69) =
= -109,5 kJ • mol-1,
Wyszukiwarka
Podobne podstrony:
skan0284 287 Elektrochemia Jeśli zapisać E°(T) = a0 + axT + a2T2 + a2T3, to (dE°\~w)p = a +2aiT+^T =
img224 (5) 287 286 287 286 Jeśli chodzi o drugie Dvtam, * tU °t0C2en- -akroehonoLc
skan0297 300 Elektrochemia 300 Elektrochemia ^nh4oh aNH4 pA b = pOH + lg skąd, po uwzględnieniu (6.6
skan0299 302 Elektrochemia ba rodzajów cząstek, które należy wziąć pod uwagę, wynosi 5 (ET, OH-, HA-
39748 skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p A
nim zjawiska elektrolizy, jeśli mierzyć będziemy temperaturę drutu - stwierdzimy, że się ona podwyżs
skan0281 284 Elektrochemia dla kilku molalności m w temperaturze 25°C wynosi m ■ 103 [mol • kg
skan0289 292 Elektrochemia Tabela 6.9 i /[M] Ig y± y± c [M] A ■, = C/_! - Ci 1 1,889 •
snap 3 Niezbędnik elektronika 2.7 by Karol Białek □0® I Katalogi Dekodery Obliczenia
więcej podobnych podstron