img030 (48)
Ćwiczenie nr. 9. Str.6
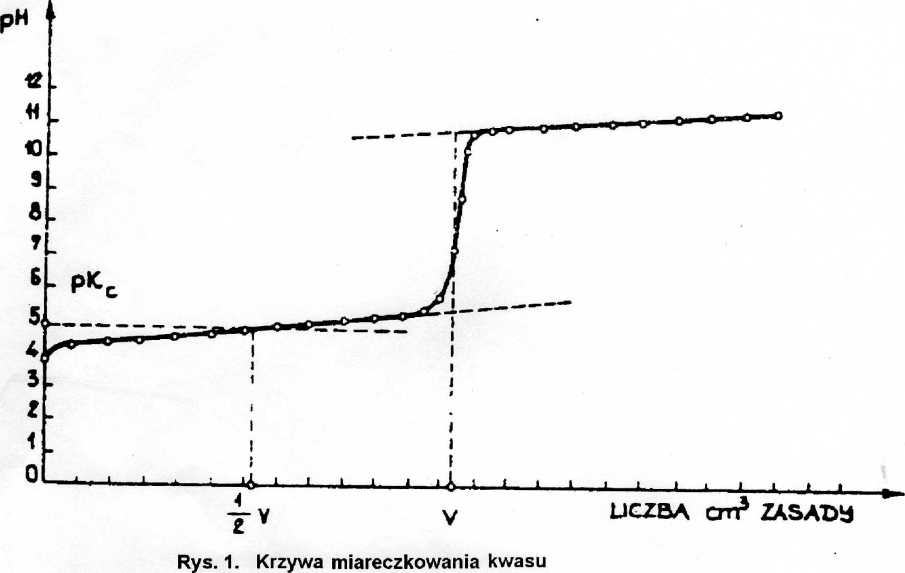
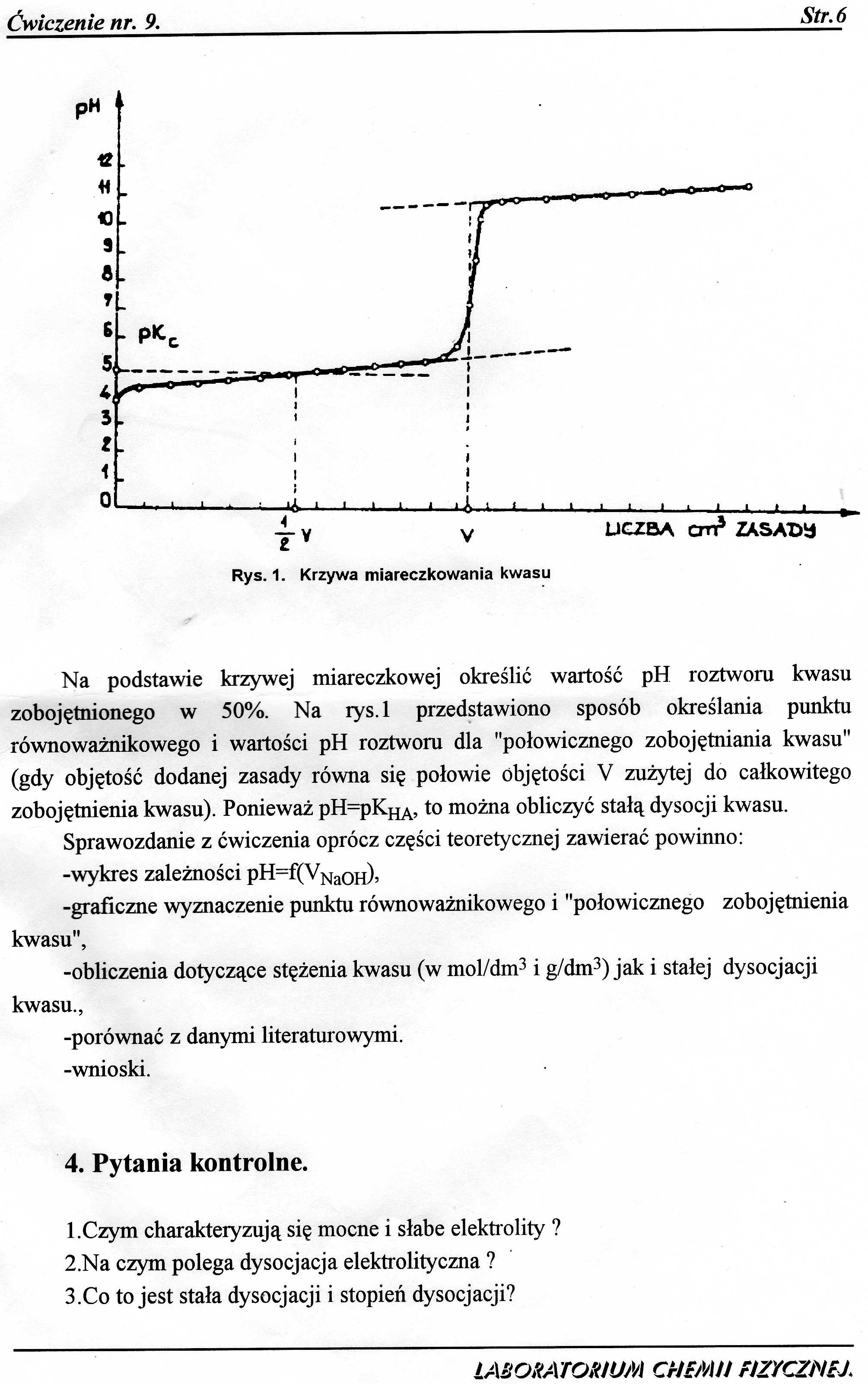
Na podstawie krzywej miareczkowej określić wartość pH roztworu kwasu zobojętnionego w 50%. Na rys.l przedstawiono sposób określania punktu równoważnikowego i wartości pH roztworu dla "połowicznego zobojętniania kwasu" (gdy objętość dodanej zasady równa się połowie objętości V zużytej do całkowitego zobojętnienia kwasu). Ponieważ pH=pKHA, to można obliczyć stałą dysocji kwasu.
Sprawozdanie z ćwiczenia oprócz części teoretycznej zawierać powinno:
-wykres zależności pH=f(VNa0H),
-graficzne wyznaczenie punktu równoważnikowego i "połowicznego zobojętnienia kwasu",
-obliczenia dotyczące stężenia kwasu (w mol/dm3 i g/dm3) jak i stałej dysocjacji kwasu.,
-porównać z danymi literaturowymi.
-wnioski.
4. Pytania kontrolne.
1. Czym charakteryzują się mocne i słabe elektrolity ?
2. Na czym polega dysocjacja elektrolityczna ?
3. Co to jest stała dysocjacji i stopień dysocjacji?
LABORATORIUM CHEMII FIZYCZNEJ.
Wyszukiwarka
Podobne podstrony:
Laboratorium elektrotechniki - ćwiczenie nr 10 na podstawie pomiaru napięcia na rozwartych zaciskach
PROGRAM ROZWOJOWY POLITECHNIKI WARSZAWSKIEJ 5.2. Na podstawie PN 60601-1 określić wartości parametró
Zdjęcie0001 Zadanie Na podstawie poniższych danych określ wartość nieruchomości gruntowej zabudowane
Na podstawie wykresu Wohlera określamy wartości Gm, Ga odpowiadające granicy trwałej wytrzymałości
DSC02211 (2) Zadanie 2. Na podstawie energii wiązań określ wartość entalpii reakcji przebiegającej w
PROGRAM ROZWOJOWY POLITECHNIKI WARSZAWSKIEJ 5.2. Na podstawie PN 60601-1 określić wartości parametró
img028 (44) Ćwiczenie nr. 9. Str.4a = Metody doświadczalne wyznaczania stałych równowag polegają na
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
L.F.B. ĆWICZENIE NR 1 Str. 2 Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 2 Str. 2 Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 3 Str. 2Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 4 Str. 2Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 6 Str. 2 Instytut Inżynierii BudowlanejKatedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
więcej podobnych podstron