Obraz (1146)

wych wiązań między tlenem i azotem wymaga, żeby jeden elektron został przeniesiony od atomu azotu do tlenu. Po utracie elektronu atom azotu ma pojedynczo obsadzony orbita/ p i może utworzyć wiązanie z jednym z atomów tlenu. Przeniesienie elektronu oznacza jednak powstanie ładunków elektrycznych, dodatniego przy atomie azotu i ujemnego przy jednym z atomów tlenu, dzięki czemu między tymi atomami powstaje wiązanie jonowe, oprócz istniejącego już między nimi wiązania o. W rzeczywistości jednak oba wiązania azotu z tlenem są jednakowe (mają jednakową długość) i trzeba wobec tego przyjąć, że rozmieszczenie elektronów w grupie nitrowej nie może być przedstawione jednym wzorem. Rzeczywistą budowę grupy NOj trzeba zatem przedstawiać wzorami rezonansowych struktur granicznych. W codziennej praktyce nie ma jednak potrzeby wypisywania obu struktur granicznych za każdym razem, gdy chcemy przedstawić budowę grupy nitrowej.
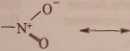
O
—N+
0“
struktury graniczne grupy nitrowej
Z budowy elektronowej wynika, że związki nitrowe są silnie polarne, podobnie jak inne związki, których cząsteczki zawierają wiązania koordynacyjne. Zgodnie z tym związki nitrowe mają duże stałe dielektryczne (6 - 25 - 35 dla nitroalkanów) i momenty dipolowe (3,4 - 3,7 D dla nitroalkanów, 4,3 D dla nitrobenzenu), Z tego powodu związki nitrowe są dość dobrymi rozpuszczalnikami.
Uderzająco duży jest wpływ grupy nitrowej na lotność związków. Wprowadzenie jednej grupy nitrowej do cząsteczki węglowodoru podwyższa temperaturę wrzenia o ponad IOO°C, mimo że asocjacja cząsteczek nhrozwiązków nie jest spowodowana wiązaniami wodorowymi.
11J. Tautomeria i kwasowe własności związków nitrowych
Tautomena jest szczególnym rodzajem izomerii konstytucyjnej. Izomerię nazywamy tautomerią gdy izomery mogą się w siebie przekształcać w reakcjach odwracalnych i istnieją w równowadze ze sobą. Prze-
kształcenia tautomeryczne polegają na zmianach po-łożenią atomów wodoru.
Zwitki zawierające atom wodoru w położeniu a względem grupy nitrowej są kwasami (nitromctan ma pK* = 10.2). Kwasowy charakter związany Jest z przemianą tautomcryczną, polegającą na odwracalnej wędrówce protonu od atomu węgla do atomu tlenu w grupie nitrowej:
|
/OH |
ST | |
|
CHj—N* |
5= CH2=N^ |
CHj-N* + H* |
|
xo- |
o- |
O" |
|
nitrometan |
aci-nitrometan |
anion |
|
aci-nitrometanu |
(przedrostek aci- służy do tworzenia nazw tautomerycznych odmian nitroalkanów, powstających przez przeniesienie protonu od atomu węgla do atomu tlenu).
Umieszczanie ujemnego ładunku anionów nitrozwiązków tylko przy atomach tlenu jest uproszczeniem. W rzeczywistości ładunek ten jest zdelokaiizo-wany i znajduje się też przy atomie węgla. Rzeczywistą budowę anionu aci-nitrometanu przedstawiać trzeba za pomocą struktur granicznych. Ujemny ładunek przy atomach węgla nadaje anionom nitroalkanów własności nukleofilo-we, co znajduje zastosowanie w syntezie organicznej.
-CHj-N

struktury graniczne anionu aci-nitrometanu
Kwasowy charakter aci-nitroalkanów powoduje, że związki te, praktycznie nierozpuszczalne w wodzie, dobrze rozpuszczają się w roztworach NaOH. Jest to zjawisko odwracalne, po zakwaszeniu roztworu następuje wydzielenie związku nitrowego.
Wyszukiwarka
Podobne podstrony:
30537 Obraz (2453) rod*wodór. W następnym etapie następuje przeniesienie wodoru od atomu rodu do ato
Obraz (2004) 396 Selektywne utleniania mannitolu z rozerwaniem wiązania między Cj i C< można wyko
66710 Obraz (2487) 68 walencyjne wiązań podwójnych OO i ON i wiązań między atomami węgla w pierścien
IMGe90 [slajdy] Wiązania między atomami w materiałach ceramicznych
38007 skan0021 K( j {[ GR. A TRAW O K OHSTYTU CYJ N ii i. Ratyfikacja przez RP umowy międzynarodowej
więcej podobnych podstron