P1020617
Równanie Stokesa-Robinsona
|
-A- |
z- | |
|
“°'t 1 + BaJI | ||
Równanie to umożliwia obliczenie średnich współczynników aktywności elektrolitu w roztworach o stężeniach nie wyższych od 0,2 mol/f.
A,B- stałe zależne jedynie od właściwości rozpuszczalnika
B—miara największego zbliżenia jonów w roztworze, najlepiej traktować ten parametr empirycznie i obliczać jako parametr dobiera Iny a- średnica hipotetycznej kufi mieszczącej dany jon ( a równa się w przybliżeniu promieni jonowych)
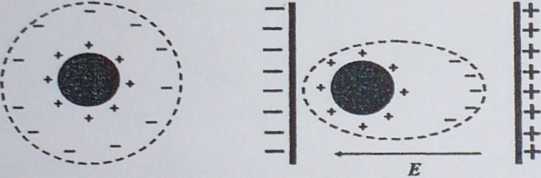
Szybkość poruszania się cząstki w polu elektrycznym nazywamy ruchliwością elektroforetyczną.
v
um =—
* E
v- prędkość cząstki £—natężenie pola elektrycznego
146
|
E,-z+'z~'e - |
«•#... | |
|
3ekT |
i*" | |
|
a &nNAe2 , |
Iz -z I |
A\ +A\ |
|
0-——A—/ |
<p-}1 r1 |
m m |
|
jo B O |
kl+k- | |
|
e — ładunek elementarny | ||
|
e* - przenikalność elektryczna ośrodka |
148 | |
|
k - stała Boltzmanna | ||
logf± f -log[l+0,001-Afx(y-nyć\
1 + o*fl-vi v
Równanie to umożliwia obliczenie średnich współczynników aktywności elektrolitu w roztworach o stężeniach nie wyższych od 4 — 7 mol/1.
A, B—stałe zależne jedynie od właściwości rozpuszczalnika
a — średnica hipotetycznej kuli mieszczącej dany jon (a równa się w przybliżeniu sumie promieni jonowych)
m — efektywna liczba sołwatacji, czyli średnia ficzba cząsteczek rozpuszczalnika w powłoce sotwatacyjnej jonu c— stężenie elektrolitu
145
mi — masa cząsteczkowa rozpuszczalnika
Czas relaksacji jest to czas, po którym jon powróci do stanu pierwotnego po wyłączeniu pola elektrycznego.
Efekt elektroforetyczny jest to hamujący wpływ chmury jonowej na nich jonu centralnego wynikający z faktu poruszania się so(watowanego jonu.
Na jon centralny, umieszczony w zewnętrznym polu elektrycznym o natężeniu działa mniejsze od niego „lokalne” pole elektryczne.
147

Wyszukiwarka
Podobne podstrony:
enzymy2 V max I S ] V =------------ Km+rSJ Równanie to pozwafa obliczyć parametry kinetyczne reakcji
SDC16837 i i Równana te umożliwiają obliczenie dwóch nieznanych kątów: o, i a,. Można unikną koniecz
SDC16837 i i Równana te umożliwiają obliczenie dwóch nieznanych kątów: o, i a,. Można unikną koniecz
42138 OMiUP t1 Gorski 0 otrzymujemy zależność: etm« = u2 (u2 “ (3.37)qv ’ ctgft2 ) n • D2 • b2 Równa
img197 197 Dla jednokierunkowego przepływu ciepłe równanie Jest następującet dt a d2 X Równanie to
P1020660 (4) Równanie mchu masy m ma postać>»
skanowanie0011 Kinetyka reakcji enzymatycznych Wyprowadzenie równania Michaelisa-Menten. Stała Micha
skan0019 l.y>. y" =* u1. Jeżeli u =s u(xCi) jest całki), okóIiii), równania (2.0.3)> to c
Slajd55 Potencjał: - funkcja V spełniająca równania: to siły potencjalne, które tworzą potencjalne p
praca zewnętrzna zamieni się na pracę techniczną i dla przemian odwracalnych równanie to przyjmie
3.4. Pierwsze prawo Kirchhoffa w postaci różniczkowej Równanie to stwierdza, że linie pola gęstości
więcej podobnych podstron