skan0064 (2)
Termodynamika chemiczna 67
3,33
3,34
3,35
3,36
3,37
1000/7
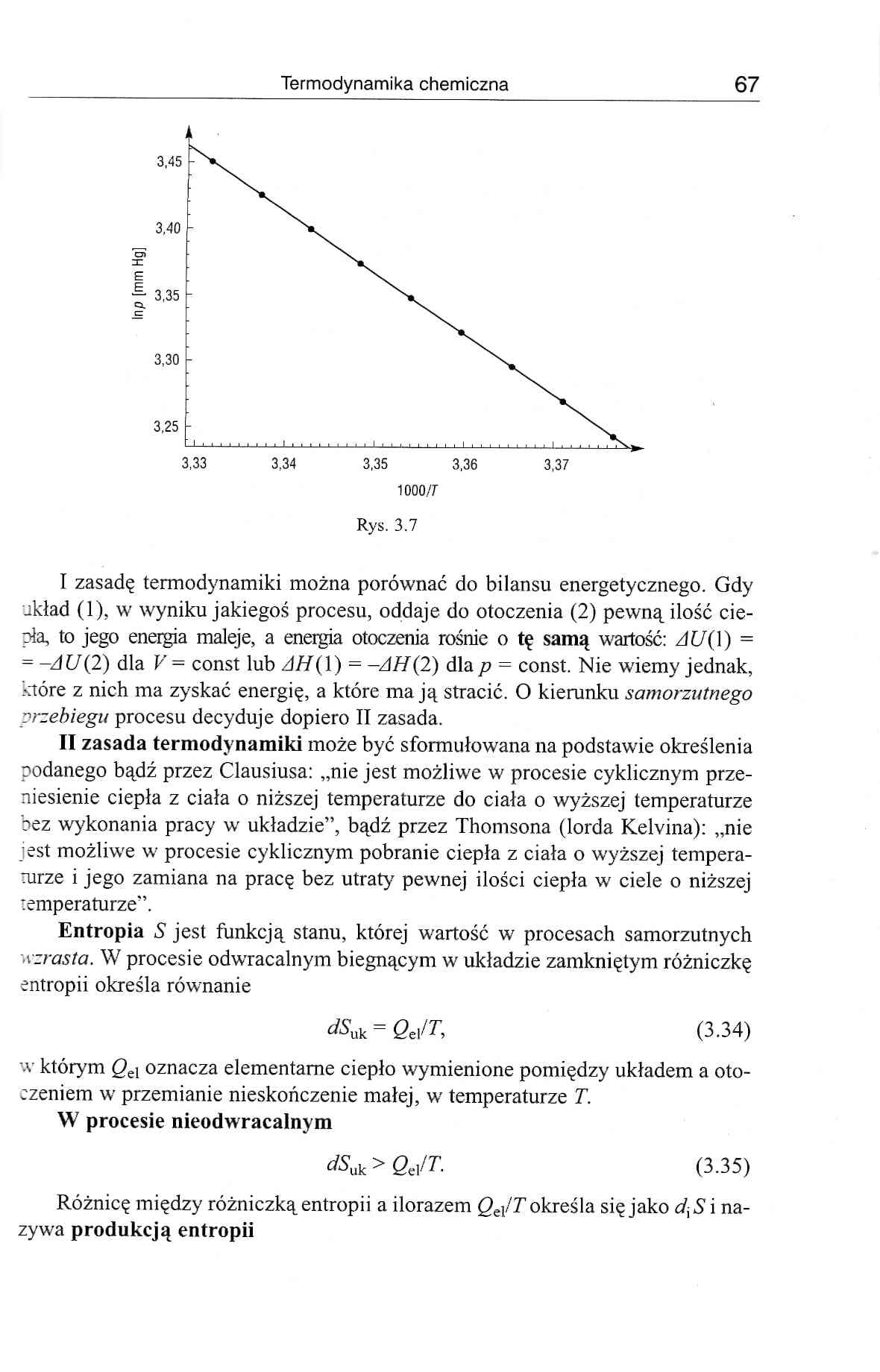
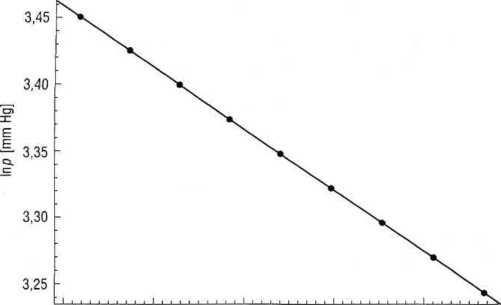
Rys. 3.7
I zasadę termodynamiki można porównać do bilansu energetycznego. Gdy układ (1), w wyniku jakiegoś procesu, oddaje do otoczenia (2) pewną ilość ciepłą to jego energia maleje, a energia otoczenia rośnie o tę samą wartość: AU(\) = = -AU{2) dla V = const lub AH{ 1) = -AH(2) dla p = const. Nie wiemy jednak, które z nich ma zyskać energię, a które mają stracić. O kierunku samorzutnego przebiegu procesu decyduje dopiero TT zasada.
II zasada termodynamiki może być sformułowana na podstawie określenia podanego bądź przez Clausiusa: „nie jest możliwe w procesie cyklicznym przeniesienie ciepła z ciała o niższej temperaturze do ciała o wyższej temperaturze bez wykonania pracy w układzie”, bądź przez Thomsona (lorda Kelvina): „nie jest możliwe w procesie cyklicznym pobranie ciepła z ciała o wyższej tempera-mrze i jego zamiana na pracę bez utraty pewnej ilości ciepła w ciele o niższej Temperaturze”.
Entropia Ó jest funkcją stanu, której wartość wr procesach samorzutnych •\zrasta. W procesie odwracalnym biegnącym w układzie zamkniętym różniczkę entropii określa równanie
(3.34)
^uk “ Qe\!T,
w którym Oel oznacza elementarne ciepło wymienione pomiędzy układem a otoczeniem w przemianie nieskończenie małej, w temperaturze T.
W procesie nieodwracalnym
(3-35)
Różnicę między różniczką entropii a ilorazem QC\!T określa się jako dxS i nazywa produkcją entropii
Wyszukiwarka
Podobne podstrony:
s11 iei wutniaki tu. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. Reakcje substratowe
.31 .32 .33 .34 .35 36 .37 .38 .39 .40 .41 .42 43 RADA KÓŁ NAUKOWYCH Koto Naukowe
Poznaj C++ w$ godziny0114 Więcej o klasach 101 32 33 34: < 35 36 37 38 39 40 41
W11 2 23 23 24 25 20 27 20 29 30 31 32 33 34 35 36 37 31 » Jeże* podczas ałsfclrolery
rys5 5 6 ’ 7 8 9 1011 12 13 14 15 16 17 18 19 1021 22 23 24 25 26 27 28 29 0331 32 33 34 35 36 37 38
Polska Izba Inżynierów Budownictwa - Krajowa Komisja Kwallfikacyjr 33 34 35 36 37 38 40 41 par.
5 (237) 33. / 34; 35. 36. 37. r/itkn z procesów fizycznych nic przebiega na poziomie molekularnym. a
54 54 31 32 33 34 35 36 37 38 Por. G. 1, 110 - 113. Por. leż li. Vollcrra: Nuovc riccrchc sulla
8111 161454 Kinm: 1 2 18 19 20 21 22 23 24 <25) 26 27 ?B 29 30 31 32 33 34 35 36 37 38 3 4
25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 mruczus.jedzenie =
więcej podobnych podstron